
- Estudiante de la Licenciatura en Nutrición en el Centro Universitario de Ciencias de la Salud (UdeG.
- Certificado en Nutrición Deportiva y Nutrición Deportiva Avanzada por Gualda Training Academia.
- Certificado en Entrenamiento Especializado para la Mujer por la Sociedad de Educación Física y Ciencias del Deporte S.C. (Sefide)
Certificado en ISAK nivel 1.
- Realizó sus prácticas universitarias con las fuerzas básicas de Leones Negros
Actualmente prestadora del servicio social en el Instituto de Ciencias Aplicadas a la Actividad Física y el Deporte.
- Participó en la campaña para detección de Obesidad, Sobrepeso y Diabetes Infantil en Sahuayo, Michoacán en el 2018
Tratamiento nutricional en pacientes con endometriosis
La endometriosis es una enfermedad en la que, en la parte exterior del útero, crece un tejido similar a la mucosa interior del útero que puede causar un dolor intenso en la pelvis y dificultar que se consiga un embarazo.
Puede aparecer a partir de la primera menstruación y hasta la menopausia.
Se trata de una patología que cursa con inflamación crónica y estrés oxidativo. Este último se produce cuando hay un desequilibrio entre los antioxidantes y las especies reactivas de oxígeno, que actúan como oxidantes; por lo que el soporte nutricional debe considerarse como parte integral del tratamiento de la enfermedad.
Aunque en algunos casos no causa síntomas, la endometriosis puede provocar dolor en la parte inferior de la barriga (la pelvis), que a veces se nota más:
En algunos casos, también causa:
RECOMENDACIONES NUTRICIONALES
La fruta y la verdura se caracterizan por su alto contenido en polifenoles y su importante poder antioxidante, por esto, las recomendaciones de fruta son como mínimo 3 raciones diarias, siendo una de ellas del grupo de los cítricos para aumentar el aporte de vitamina C y al menos 2 raciones al día de verduras, procurando incluir las de la variedad crucífera (Brócoli, coles de Bruselas, repollo, coliflor, col rizada). Una dieta antiinflamatoria ideal debería contener hasta dos tercios del volumen total de alimentos en verduras y frutas.
Introduzca el consumo de frutas antioxidantes como fresas, uvas, cerezas y arándanos.
Se recomienda evitar el consumo de carbohidratos refinados con alta carga glucémica.
Consumir cereales integrales por su elevado contenido en fibra. Cuando la endometriosis se encuentra en su fase aguda, puede consumir cereales sin gluten con el fin de disminuir la inflamación.
Se recomienda eliminar por completo los azucares refinados (bollería, alimentos ricos en maltosa, jarabe de glucosa, manitol y xilitol).
Disminuir el consumo de carne roja a 1-2 raciones/mes. En el caso de carnes magras como pollo, pavo o conejo, la recomendación es de 3-4 raciones/semana.
Con respecto a los pescados, debido a su alto contenido en omega 3 y su elevado poder antiinflamatorio se recomienda consumir 5-6 raciones/semana.
El huevo es una de las fuentes de proteína más completa que encontramos, por ello se recomienda el consumo de 5-6 huevos a la semana.
Los frutos secos y semillas se caracterizan por serricos en ácidos grasos Omega 3. La recomendación de frutos secos es de 1 ración/día.
Con respecto a las legumbres se recomiendan entre 2-3 raciones/semana. Se recomienda comprobar la tolerancia que hay hacia ellas, en caso de no ser buena, hay que optar por tomar la legumbre cocinada y triturada con batidora y pasadas por el pasapuré.
BIBLIOGRAFÍA
Organización Mundial de la Salud (OMS). 2023.
Guía de Atención a las mujeres con endometriosis en el Sistema Nacional de Salud [internet]. Madrid: Ministerio de Sanidad, Servicios Sociales e Igualdad; 2013 [consultado 04 enero 2021]. Disponible en: http://www.msc.es/organizacion/sns/planCalidadSNS/pdf/equidad/EN DOMETRIOSIS.pdf.

Desnutrición proteico-energética en adultos
La desnutrición en los países en desarrollo es multifactorial y los programas para contrarrestarla deben considerar aspectos demográficos, socioeconómicos, fisiológicos y conductuales de la nutrición.
La desnutrición en adultos incluye tanto la desnutrición proteico-energética (PEU) como la deficiencia de micronutrientes (vitaminas y minerales). Mientras que la deficiencia de vitaminas y minerales es una preocupación bien reconocida y aceptada en los adultos, la PEU no lo es.
La deficiencia energética crónica (CED), caracterizada por una masa corporal magra con bajo almacenamiento de energía, es una de las características de la desnutrición en adultos, la cual disminuye la capacidad de trabajo, por lo tanto, puede provocar inseguridad alimentaria, capacidad económica comprometida, pobreza y acceso deficiente a una atención médica adecuada.
Acciones o alteraciones que pueden desarrollar PEU:
PEU y COVID-19
La PEU se observa cada vez más en pacientes conCOVID-19, ya que puede causar desnutrición de muchas maneras. Los ingresos a cuidados intensivos, las estadías hospitalarias prolongadas, la soledad durante los aislamientos domiciliarios y el estrés de la enfermedad que resulta en una ingesta deficiente de alimentos durante la enfermedad pueden precipitar la PEU. El aumento de la carga viral, la infección, y la inflamación asociadas con el COVID-19 aumentan la demanda metabólica en el cuerpo y, por lo tanto, también pueden precipitar la PEU.
Síntomas
La palabra kwashiorkor a menudo evoca imágenes vívidas de un niño gravemente desnutrido, con edema periférico general. Por otro lado, un adulto con PEU puede estar irritable, débil, fatigado, tener un coeficiente intelectual más bajo, baja capacidad de trabajo y apatía
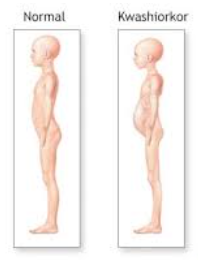
En casos graves de PEU puede haber contracción muscular, pérdida de grasa con caquexia más prominente en áreas de depósito de grasa y protrusión de huesos. Piel seca, que luce pálida, delgada e inelástica y fría. Caída profusa y resequedad del cabello.
La PEU prolongada puede presentarse como amenorrea o atrofia gonadal y pérdida de la libido en ambos sexos. Los casos más graves pueden afectar la cognición; disminuir la presión arterial, la frecuencia del pulso y el gasto cardíaco; y causar hipotermia que, si no se atiende, puede causar la muerte.
Detección
Los médicos confían en herramientas fáciles de usar, como la velocidad de la marcha, la fuerza de agarre y medidas antropométricas. Es probable que un paciente que tiene tres medidas antropométricas bajas(IMC, circunferencia de la cintura y relación cintura-altura) tenga PEU.
Tratamiento
Mejorar hábitos de alimentación. En la dieta deben predominar los alimentos con alto aporte de proteína, se puede apoyar de suplementación en caso de ser necesario.
Referencias
Kapoor N, Bhattacharya S, Agarwal N, Das S, Bantwal G, Deshmukh V, Kalra S. Subclinical Kwashiorkor in Adults: A New Age Paradigm. Indian J Endocrinol Metab. 2022 May-Jun;26(3):213-222.
Dukhi N. Global Prevalence of Malnutrition:Evidence fromLiterature. IntechOpen. 2020 doi:10.5772/intechopen. 92006.
Morley JE. Protein-Energy Undernutrition (PEU)-Nutritional Disorders. MSD Manual Professional Edition. [Last accessed on 2021 May 01]. Published2020.

El tempo y su relación con la hipertrofia
Se define hipertrofia como el incremento del volumen del tejido muscular. Particularmente, este tipo deentrenamiento puede ayudar en población con sarcopenia, dinapenia, osteopenia, pacientes con alteraciones cardiometabolicas, así como a deportistas.
Para conseguir adaptaciones estructurales y maximizar la hipertrofia, las variables del entrenamiento deben ser controladas, como por ejemplo el volumen, frecuencia, intensidad, densidad, selección y orden de los ejercicios, rango de movimiento y tempo.
El tempo hace referencia al total de tiempo que dura una sola repetición, resultante de la suma entre la fase concéntrica, isométrica y excéntrica del levantamiento. Por ejemplo, si las fases excéntrica, isométrica y concéntrica de una repetición duran 3, 1 y 3 segundos, respectivamente, el tempo total será de 7 segundos para dicha repetición. El tempo puede verse afectado por varios factores, como la carga utilizada (a mayor carga, mayor tempo concéntrico) y la fatiga (a mayor fatiga periférica y central, mayor tempo).
En el estudio de Keogh, et al, 1999, observaron que un tempo de 10 segundos (5” en fase excéntrica y 5” en fase concéntrica) produce menos hipertrofia y menor actividad electromiográfica en el pectoral frente a un tempo explosivo en el ejercicio de press de banca. También, un tempo elevado podría implicar el uso de cargas bajas, sub-estimulando las unidades motoras (UM’s) de alto umbral de activación.
Por otro lado, un menor tempo (repeticiones explosivas) podría limitar ganancias de hipertrofia al reducir el TUT (tiempo bajo tensión), aunque no necesariamente la tensión mecánica y el estrés metabólico. En tal sentido, la tensión mecánica podría ser el pilar fundamental para inducir adaptaciones estructurales. Dicho esto, Cháves, et al, 2020, no observaron diferencias en el aumento del área de sección transversal fisiológica y de la fuerza con tempo de 4 (2” de fase excéntrica y 2” de fase concéntrica) y 1.5”. Además, Nobrega, et al, 2018, observaron que los sujetos que auto controlaban la duración de cada repetición (~1.5 segundos de tempo) conseguían una mayor activación electromiográfica vs tempos de 4 segundos (2” concéntrica y 2” excéntrica). Más aún, un metaanálisis sugiere que tempos >8 segundos serían contraproducentes para producir hipertrofia, ya que un mayor tempo excéntrico podría dificultar completar un mayor volumen de entrenamiento y carga, aumentando también la fatiga acumulada y el daño muscular.
Si bien cuando existe un esfuerzo muy elevado y aumenta el grado de esfuerzo se van reclutando las UM’s de alto umbral; buscar mantener un tempo constante más extenso de lo normal impediría que esto suceda debido a que el músculo no se ve en la obligación de producir más fuerza ante la misma carga.
La evidencia actual sugiere que un tempo óptimo para obtener adaptaciones hipertróficas estaría en un rango de 2 a 6 segundos por repetición (considerando repeticiones que impliquen llegar al fallo muscular concéntrico). Tiempos más extendidos (>6 segundos) podrían no ser adecuados (por ejemplo, fatiga excesiva) y no induciría mayor hipertrofia comparado con menores tempos, aunque se requiere mayor evidencia para conclusiones más concretas.
Referencias
Benavides-Villanueva, Julio, & Ramirez-Campillo, Rodrigo. (2022). Entrenamiento con sobrecarga, duración de la repetición e hipertrofia: una revisión de la literatura. Ciencias de la actividad física (Talca), 23(1), 12. Epub 30 de junio de 2022.https://dx.doi.org/10.29035/rcaf.23.1.12
Chaves, T. S., de Campos Biazon, T. M. P., Dos Santos, L. M. E., & Libardi, C. A. (2020). Effects of resistance training with controlled versus self-selectedrepetition duration on muscle mass and strength in untrained men. PeerJ, 8, e8697. https://doi.org/10.7717/peerj.8697
Keogh, J. W. L., Wilson, G. J., & Weatherby, R. P. (1999). A cross-sectional comparison of differentresistance training techniques in the bench press. Journal of Strength and Conditioning Research, 13(3), 247-258. https://journals.lww.com/nsca-jscr/Abstract/1999/08000/A_Cross_Sectional_Comparison_of_Different.12.aspx
Nóbrega, S. R., Barroso, R., Ugrinowitsch, C., da Costa, J. L. F., Alvarez, I. F., Barcelos, C., & Libardi, C. A. (2018). Self-selected vs. Fixed Repetition Duration: Effects on Number of Repetitions and MuscleActivation in Resistance-Trained Men. Journal of Strength and Conditioning Research, 32(9), 2419-2424. https://doi.org/10.1519/JSC.0000000000002493

ACRILAMIDAS EN LOS ALIMENTOS
La acrilamida es una sustancia química que se crea de forma natural en productos alimenticios que contienen almidón durante procesos de cocinado cotidianos a altas temperaturas (fritura, tostado, asado y también durante procesos industriales a 120ºC y a baja humedad).
Alimentos con acrilamida: papitas fritas; galletas y pan; cereales para desayuno; aceitunas negras en lata; jugo de ciruela y café.
La concentración de acrilamida en los alimentos varía ampliamente dependiendo del fabricante, del tiempo de cocción y del método y temperatura del proceso de cocción. La disminución del tiempo de cocción para evitar un tostado o dorado en exceso; blanquear las papas antes de freírlas; no guardar las papas en el refrigerador; y secarlas (en un horno de aire caliente después de freírlas) son formas de reducir el contenido de acrilamida en algunos alimentos.
Estudios en modelos murinos han encontrado que la exposición a la acrilamida incrementa el riesgo de varios tipos de cáncer. En el cuerpo, la acrilamida se convierte en un compuesto químico llamado glicidamida, la cual causa mutaciones y daños al ADN.
Sin embargo, un gran número de estudios epidemiológicos en humanos no han encontrado una evidencia consistente de que la exposición a la acrilamida de la dieta esté asociada con el riesgo de algún tipo de cáncer. Cabe mencionar que se consideran datos inconsistentes debido a la dificultad para determinar el consumo de acrilamida de una persona basándose en la dieta reportada por la persona.
El informe de carcinógenos del Programa Nacional de Toxicología considera que se puede anticipar con razón que la acrilamida es un carcinógeno humano, según estudios con animales de laboratorio a los que se les dio acrilamida en el agua para beber. Sin embargo, estudios de toxicología han mostrado que los humanos y los roedores no solo tienen índices diferentes de absorción de la acrilamida, sino que también la metabolizan en forma diferente.
Estudios de exposición en el entorno laboral han mostrado que la exposición ocupacional a concentraciones elevadas de acrilamida (la cual ocurre por inhalación) causa daño neurológico, por ejemplo, en los trabajadores que usan polímeros de acrilamida para aclarar el agua en plantas de preparación de carbón.
“Acrilamida y el riesgo de cáncer publicada originalmente por el Instituto Nacional del Cáncer.”2017. Disponible en: https://www.cancer.gov/espanol/cancer/causas-prevencion/riesgo/dieta/hoja-informativa-acrilamida

Importancia de la vitamina C en el ejercicio físico
La vitamina C es utilizada en estrategias de suplementación, con el objetivo de mejorar el rendimiento y disminuir la fatiga del deportista. Tiene bastantes posibilidades de aplicación como ayuda ergogénica:
– El ejercicio con componente aerobio destacable, produce una fuerte carga de oxígeno, que puedealterar el equilibrio de los sistemas celulares de óxido-reducción, provocando una importante formación de radicales libres, con riesgo de daño tisular.
– Es necesaria para la síntesis de carnitina, que transporta al interior de la mitocondria los ácidos grasos, los cuales son el combustible mayoritario en ejercicios de larga duración.
– Ayuda a contrarrestar el riesgo de anemia ferropénica, frecuente en la fatiga crónica y el sobreentrenamiento, especialmente en mujeres.
– Participa en la reparación tisular durante y especialmente después del esfuerzo, especialmente en el ejercicio excéntrico.
– En ejercicios extenuantes y de larga duración puede postularse una acción antifatiga.
– Tiene actividad inmunoestimulante que ayuda a prevenir las infecciones respiratorias o del tracto gastrointestinal, muy frecuentes después del esfuerzo intenso o en la condición de sobreentrenamiento.
Por lo tanto, la suplementación con vitamina C en el ejercicio puede ser crucial para optimizar el desempeño deportivo de un atleta, ya que participa en gran cantidad de procesos. Las recomendaciones de dosis varían según las funciones que se busquen mejorar.
Referencia
Barbany J. R, Javierre C. VITAMIN C SUPPLEMENTATION AND SPORT PERFORMANCE (II). Archivos de medicina del deporte. VOLUMEN XXIII – N.º 112 – 2006.

Importancia de los carbohidratos en atletas de resistencia de alta intensidad
Los carbohidratos son el sustrato energético más importante en deportes de resistencia. Sin embargo, no siempre ha sido el caso. En el inicio de los Juegos Olímpicos modernos en 1896, la proteína se creía la fuente de energía más importante para los atletas.
Otro trabajo fundamental realizado en la década de 1960, aclaró la importancia de los carbohidratos para el ejercicio y, en particular, el papel del glucógeno muscular en el rendimiento de atletas de resistencia.
En deportes de resistencia la demanda de energía y de carbohidratos se ve aumentada; la disponibilidad suficiente de energía de los carbohidratos es necesaria para que los atletas mantengan las demandas de la competencia y se recuperen para las competencias posteriores.
La capacidad para realizar sesiones de alta intensidad depende de la disponibilidad de energía para la producción de trifosfato de adenosina (ATP) puede derivarse tanto de las grasas como de los hidratos de carbono, sin embargo, son los hidratos de carbono los que se utilizan principalmente en ejercicios de alta intensidad.
Los requerimientos de energía para las carreras pueden exceder la capacidad para almacenar carbohidratos en más del 100%. Para ello se han propuesto estrategias como aumentar el almacenamiento de carbohidratos antes del inicio de la competencia, también conocido como carga de carbohidratos o glucógeno.
Además de las manipulaciones de disponibilidad de carbohidratos, también se debe considerar entrenar el intestino para que se convierta en parte del proceso de entrenamiento para mejorar potencialmente la tolerancia a altas tasas de ingesta de carbohidratos durante el ejercicio, ya que la prevalencia de problemas gastrointestinales durante el ejercicio es grande.
Precompetencia
Las reservas de carbohidratos previas al ejercicio influyen en el desempeño del atleta. Con entrenamiento mejorado y manipulaciones dietéticas, la capacidad de almacenar glucógeno muscular puede aumentar en poblaciones altamente entrenadas.
Se ha demostrado que la carga de glucógeno aumenta la capacidad del ejercicio al ahorrar la reserva de glucógeno intramiofibrilar y que ésta reserva en las fibras musculares tipo I es el mejor predictor de la capacidad de ejercicio prolongado. Durante esfuerzos de alta intensidad la disponibilidad de glucógeno se puede agotar más rápido por la participación de las fibras tipo II y esto podría indicar que el contenido de glucógeno en ese grupo es más importante a estas intensidades.
Para lograr la carga de glucógeno muscular, se recomienda un alto consumo de carbohidratos (es decir, 10–12 g·kg masa corporal (MC), 36–48 h previas a la competencia. no se recomienda realizar la carga de glucógeno para eventos <90 min.
Sin embargo, es común que los atletas realicen una sesión de ejercicio en este marco de tiempo, durante el cual algunos utilizarán el glucógeno almacenado. Además, algunos eventos deportivos (por ejemplo, grandes vueltas en bicicleta) consisten en carreras que tienen lugar diariamente cuando hay menos de 24 h disponibles para la recuperación, y en estos escenarios, la optimización de la ingesta de carbohidratos en el período de recuperación posterior al ejercicio es primordial.
La variación de la ingesta de carbohidratos sí cambia las concentraciones de glucógeno hepático en ayunas, lo que demuestra que se requiere una cantidad suficiente de carbohidratos para comenzar una sesión de ejercicio con reservas de glucógeno hepático normales.
Durante la competencia
Las pautas nutricionales actuales para deportistas aconsejan consumir carbohidratos durante el ejercicio en diferentes proporciones y en relación con la duración del ejercicio con el fin de mejorar el rendimiento del mismo.
Actualmente hay dos mecanismos propuestos para la ergogenicidad (medio para aprovechar la energía) de los carbohidratos. En primer lugar, los carbohidratos pueden ser detectados en la cavidad oral, provocando una activación de ciertas regiones del cerebro, lo que conduce a la estimulación del sistema nervioso central, como lo demuestra la mejora del rendimiento con un enjuague bucal de carbohidratos. En segundo lugar, los carbohidratos proporcionan una fuente de combustible adicional para la formación de ATP durante el ejercicio.
La ingesta de carbohidratos durante el ejercicio de larga duración mantiene estables los niveles de glucosa en sangre, además evitan por completo la descomposición del glucógeno hepático.
La recomendación va hasta 60 g·h de ejercicio para sesiones de ejercicio que duran hasta 3 h.
Post competencia
El objetivo principal es la recuperación del glucógeno hepático y muscular.
Se debe asegurar una optimización de la ingesta de carbohidratos para escenarios en los que la siguiente sesión de competición de alta intensidad se sigue en <36 h.
Para una reposición completa de las reservas de glucógeno muscular, se requieren de 24 a 36 h, mientras que, para la reposición completa del glucógeno hepático, se necesitan de 11 a 25 h.
La recomendación es ingerir carbohidratos de índice glucémico moderado a alto tan pronto como sea posible a razón de 1,0–1,2 g·kg MC·h para optimizar la reposición de las reservas de glucógeno durante las primeras 4 h.
Baja disponibilidad de carbohidratos y RED-S
Desafortunadamente, la prevalencia de la Deficiencia Energética Relativa en el Deporte (RED-S) sigue siendo alta.
Existe evidencia de que una ingesta suficiente de carbohidratos puede mejorar los síntomas de sobreentrenamiento.
Referencia
- Podlogar, G. A. Wallis. New Horizons in Carbohydrate Research and Application for Endurance Athletes. Sports Medicine (2022) 52 (Suppl 1):S5–S23.

Estradiol y sus efectos en el peso corporal
El estradiol es una hormona esteroidea sexual femenina. Pertenece a una clase de medicamentos llamados hormonas de estrógeno. Funciona al reemplazar el estrógeno que es normalmente producido por el cuerpo.
Los estrógenos, secretados principalmente por las gónadas femeninas, son responsables de los cambios, genitales y extragenitales, que ocurren en la pubertad de las niñas.
En el hombre, la grasa se acumula principalmente en el subcutáneo abdominal y depósitos viscerales con menor cantidad en piernas y caderas, llamada distribución central o androide. Por el contrario, en las mujeres se acumula en las piernas, caderas, muslos y mamas, llamada distribución femenina, ginecoide o periférica.
La distribución de la grasa corporal se relaciona con las características sexuales secundarias, por lo tanto, es común pensar que las hormonas intervengan en su distribución, así pues, las mujeres acumulan más grasa a nivel de las regiones inferiores del cuerpo, la cual es una función reproductiva-sexual normal.
Desde el punto de vista de procesos de adaptación, se argumenta que la distribución ginecoide de la grasa es almacenada para la lactancia y la alimentación del recién nacido, mientras que los hombres la activan para correr o pelear, así como en situaciones de defensa y cacería.
En la etapa premenopáusica la progesterona aumenta la actividad de la lipoproteína lipasa principalmente en la región gluteofemoral, mientras que los estrógenos la suprimen. Después de la menopausia los estrógenos son producidos principalmente por la conversión o aromatización de los andrógenos suprarrenales por el tejido adiposo, mientras que la progesterona cae de manera drástica, debido a una producción suprarrenal mínima. Normalmente todas las mujeres exhiben incremento de su peso corporal después de la menopausia, con tendencia a acumular grasa subcutánea abdominal y visceral.
Los estrógenos también son potentes anorexígenos, ya que inhiben las concentraciones de la hormona melanina que se halla en hipotálamo y que parece estar envuelto en la regulación del anorexígeno leptina, que actúa sobre receptores cerebrales y suprime la expresión de la melanocortina (MC) y de su receptor. La administración intracerebral de MC induce hiperfagia, mientras su deficiencia causada por “deleción” del gen conduce a hipofagia y pérdida de la grasa corporal.
En un estudio se evaluó la administración de 2 mg de beta estradiol/día en hombres ejercitándose en bicicletas durante 8 días, lo que ocasionó una disminución de la oxidación de los carbohidratos en 5% – 16% y la de leucina en 1%, indicando un limitado efecto sobre el glucógeno y el músculo, y un incremento de la oxidación lipídica en 22% – 24 % en reposo y durante el ejercicio. Los autores de este estudio, concluyeron que los estrógenos influyen en la energía en reposo y durante el ejercicio en hombres, reduciendo la dependencia de aminoácidos y carbohidratos, reforzando el concepto que se tiene de los lípidos como fuentes de energía.
En otro estudio donde se administró beta estradiol (500 μg/kg, 2 o 4 semanas) a ratas machos hubo significantemente una reducción del peso corporal. La lipólisis basal y la inducida por adrenalina fueron significantemente elevadas en el tejido adiposo del epidídimo de ratas machos tratados con 7 mg de B estradiol 12 h antes o con estradiol 500 μg/kg por 2 semanas, demostrándose que el estradiol ejerce fuertes efectos sobre el metabolismo del tejido adiposo, posiblemente mediados por AMP cíclico. Los ratones con receptores “knockout” para estrógenos o con deficiencia en aromatasa se hacen obesos.
Referencias
- Speroff L, Glass RH, Kase NG. Clinical Gynecologic Endocrinology and Infertility. 6ª edición. Baltimore: Lippincott Williams & Wilkins, editores. Baltimore 1999.
- J de Santiago García M, León C, Cabrillo Rodríguez E. Fisiología femenina I: Ciclo ovárico. Fisiología del ovario: gametogénesis. Ovulación. Esteroidogenésis. Acciones de las hormonas ováricas. Ciclo y fisiología tubárica. En: Cabero Roura L, editor. Tratado de Ginecología, Obstetricia y Medicina de la Reproducción. Madrid: Editorial Médica Panamericana, S.A; 2003.p.73-83.
- Velásquez N. El papel de los esteroides sexuales en la distribución de la grasa corporal y su relación con la obesidad del síndrome de ovario poliquístico. Rev Obstet Ginecol Venez. 71(1): 2011.

Beta alanina, ¿la necesito consumir?
Los atletas que participan en deportes y eventos de alta intensidad (1- 10 min de esfuerzo máximo), o en actividades en las que se requiere realicen esfuerzos repetidos de alta intensidad, tienen determinantes de rendimiento únicas. Todos estos deportes utilizan grandes cantidades de producción de energía del adenosín trifosfato (ATP) de origen anaeróbico a partir de la fosfocreatina y la glucólisis anaeróbica, resultando esta última en una gran acumulación de lactato. La diversidad de estos determinantes únicos de rendimiento de alta intensidad prevalece especialmente en los eventos basados en distancias medias/alta intensidad, que presentan una combinación de características aeróbicas, anaeróbicas y neuromusculares/mecánicas y muchas de estas determinantes están vinculadas a intervenciones nutricionales. De hecho, los límites del rendimiento de alta intensidad son multifactoriales, pero un factor limitante importante es la capacidad para tolerar niveles cada vez mayores de acidosis muscular; tanto intra como extracelular. Para mejorar la amortiguación extracelular, se ha investigado y utilizado la carga de bicarbonato de sodio durante varias décadas.
La carnosina es un amortiguador intracelular clave debido a que contiene nitrógeno, que puede aceptar (amortiguar) H+ y enlentecer la disminución del pH muscular durante ejercicio intenso. Se ha sugerido que la contribución de los niveles normales de carnosina muscular a la capacidad amortiguadora total del músculo intracelular es 6-7%, pero puede llegar a 15% del total cuando se aumenta mediante suplementos de beta-alanina.
La ingestión oral de beta-alanina durante varias semanas aumentó un 40-60% la carnosina muscular en humanos. La limpieza de la carnosina elevada en el músculo esquelético después de la finalización de la suplementación con beta-alanina es muy lenta, con un tiempo de limpieza estimado de 14 a 15 semanas después de un aumento de 50% en la carnosina muscular. El factor que más contribuye a la síntesis de carnosina es la dosis y la duración de la suplementación con beta-alanina, ya que los estudios han demostrado que duplicar la dosis diaria de beta-alanina produce aproximadamente el doble de la cantidad de carnosina sintetizada.
En datos actuales también se han mostrado varias formas potenciales de aumentar la eficiencia de la síntesis de carnosina con la suplementación de beta-alanina, ya que solo 5% de la beta-alanina ingerida se puede considerar en el músculo como carnosina, y el resto tiene un destino metabólico desconocido. Estos incluyen: (1) tomar beta-alanina con una comida (aprovechando el efecto de la insulina); (2) usar beta-alanina de liberación lenta, en comparación con la forma pura, produce una mayor síntesis de carnosina; y (3) realizar entrenamiento/ejercicio mientras se suplementa.
Advertencia. Cuando se suplementa la beta-alanina en niveles superiores a 800 mg/dosis, se produce parestesia leve en la mayoría de los sujetos (“hormigueo”, vasodilatación de la piel y enrojecimiento durante 60-120 min).
Referencias
Trent Stellingwerff, PhD I. Actualización sobre la suplementación con beta-alanina para atletas. Sports Science Exchange (2020) Vol. 29, No. 208, 1-6.
Bex, T., Chung, W., Baguet, A., Achten, E., & Derave, W. (2015). Exercise training and Betaalanine-induced muscle carnosine loading. Front Nutr, 2, 13.

Anorexia nerviosa
La anorexia nervosa (AN) forma parte de los trastornos de la conducta alimentaria, se caracteriza por un peso anormalmente bajo, miedo intenso a ganar peso, una percepción distorsionada de peso y forma corporales, y la aparición de la amenorrea en las mujeres.
Las percepciones distorsionadas de su cuerpo favorecen el mantenimiento del cuadro anoréxico, pues genera ansiedad y lleva al paciente a continuar la dieta.
El término anorexia, aunque etimológicamente significa pérdida del apetito (derivado del prefijo “an” y del griego “orexis”) no está adecuadamente expresado, pues las personas con anorexia nerviosa se niegan a comer para conseguir la delgadez, pero la sensación de hambre puede estar presente, en cualquier etapa de la enfermedad. Regularmente sólo pierden el apetito cuando están en pleno estado de emaciación.
La anorexia nerviosa se presenta fundamentalmente en el sexo femenino (menos del 10 % de las personas anoréxicas son del sexo masculino).
La población con mayor riesgo para estas alteraciones son los adolescentes, que atraviesan una etapa de transición sujeta a cambios físicos, cognitivos, psicológicos, sociales, y que asumen formas de los diferentes entornos sociales y culturales donde se desarrollan. La búsqueda de la delgadez es para ellos el centro de su vida. Este estilo de pensamiento extremo los lleva a una disciplina muy rígida en la dieta, cuyo éxito le da un sentido de eficiencia a sus vidas y la sensación de tener un núcleo de personalidad propio.
La evolución de la anorexia nerviosa puede ser variada: algunas personas se recuperan totalmente después de un único episodio; otras presentan episodios fluctuantes, con ganancia de peso seguido de recaídas; y en otros casos, si no se establece un programa terapéutico, puede surgir un desarrollo de progresiva desnutrición con la posibilidad de desembocar en estados caquécticos, y la muerte por inanición, suicidio o desequilibrio metabólico.
CLASIFICACIÓN
- Leve: IMC de 17 a 18.49 kg/m2
- Moderado: IMC de 16 a 16.99 kg/m2
- Grave: IMC de 15 a 15.99 kg/m2
- Extremo: IMC <15 kg/m2
Por lo general estos pacientes comienzan con una disminución de la ingesta, sobre todo de alimentos con alto contenido calórico (hidratos de carbono y grasas), y muchos de ellos acaban con una dieta muy restringida, incluyendo la práctica del ayuno. Otra conducta destacable es el ejercicio físico excesivo, ya que no reconocen el cansancio, además es una autodisciplina para no subir de peso.
Su estado de ánimo es vulnerable. Son comunes los sentimientos de desamparo, de depresión, de ansiedad. Se destaca también el sentido de ineficacia y baja autoestima, lo cual está en estrecha relación con el miedo a perder el control sobre sí, reflejándose desconfianza personal. Esta desconfianza se apoya en sistemas de referencia externos. No dan opiniones, presentan perfeccionismo excesivo, autoexigencia, sumisión, obediencia hacia figuras de autoridad.
Muchos de los signos y síntomas de la anorexia nerviosa son atribuidos a la inanición. Además de la amenorrea, puede haber estreñimiento, intolerancia al frío, hipotensión, hipotermia, bradicardia, sequedad de la piel. También pueden presentarse lanugo, edemas periféricos, anemia, leucopenia. Algunas veces el color de la piel es amarillento. Puede aparecer también atrofia mamaria, reducción del vello axilar y pubiano, metabolismo basal disminuido, etc.
El paciente con anorexia nerviosa, desde el punto de vista nutricional, presenta una ingesta deficitaria de minerales, por ejemplo: calcio, hierro y zinc. Se detectan valores séricos altos de caroteno y vitamina A, las vitaminas E y B6 pueden aparecer deficitarias, mientras que la vitamina C, puede estar normal o elevada, pues una gran parte de los alimentos se consumen crudos, y, por lo tanto, no sufren importantes reducciones en el contenido de esta vitamina. El aporte de proteínas también puede ser normal en los anoréxicos.
Referencias
- Manual de diagnóstico y estadística de los trastornos mentales (DSM-IV). (1995). Barcelona: Ed. Masson, 557 (9).
- Calvo R. (1992). Trastornos de la alimentación (I): análisis. En: Avances en el tratamiento de los trastornos de ansiedad. Madrid. Ediciones Pirámides, 211 (25).
- Perpiñá TC. (1989). Trastornos alimentarios: el estado de la cuestión. Valencia: Promolibro, 7-24.
- Rodríguez M. (2000). Anorexia nerviosa: características y síntomas. Rev Cubana Pediatr: 72 (4). Ciudad de la Habana.

Deficiencias nutricionales relacionadas con el hábito de fumar
El consumo de tabaco puede provocar un cuadro de intoxicación aguda, aunque habitualmente sólo se presenta en las personas que empiezan a fumar de forma intensa. Esta intoxicación aguda se debe, básicamente, a la nicotina y al monóxido de carbono. Sin embargo, lo que normalmente nos preocupa es la intoxicación crónica; en este sentido, el consumo continuado de tabaco causa, fundamentalmente por culpa de los componentes del humo, una serie de alteraciones en diversos órganos con la aparición de una patología característica. Evidentemente, la constitución del fumador, la edad en la que empezó a fumar, su intensidad, el tiempo que lleva fumando, las características del tabaco, la forma de fumar, etc., hacen variar la forma y manifestación de estas enfermedades.
Los fumadores constituyen un grupo importante de la población con una problemática nutricional concreta y que, consecuentemente, merece especial atención.
Hay evidencia científica suficiente para afirmar que la dieta de los fumadores suele ser menos adecuada que la de los no fumadores. La hipótesis, difícil de establecer de manera concluyente, es que el fumador al no preocuparse por su salud, también se preocupa en menor medida de su dieta. El tabaco puede modificar las preferencias alimentarias, el sentido del gusto y en definitiva alterar los hábitos alimentarios: la ingesta de energía, fibra y nutrientes. Además, hay una marcada relación dosis/efecto: a mayor número de cigarrillos fumados al día, mayores son las alteraciones.
Conocemos por muy diversos estudios que los no fumadores siguen una dieta con una mejor densidad de nutrientes: consumen más frutas, verduras, hortalizas ricas en vitamina C y ß-carotenos, cereales (sobre todo integrales) y también leche y productos lácteos. Mientras que, en los fumadores, es mayor el consumo de café y alcohol.
Los patrones diferentes ya comentados de consumo de alimentos hacen también que la ingesta de vitaminas y minerales sea más baja. También resulta significativo el hecho de que en la población fumadora es menos habitual el consumo de suplementos y alimentos enriquecidos. De manera específica, se observan ingestas reducidas y niveles séricos inferiores para los llamados nutrientes antioxidantes.
En nuestro país hay datos epidemiológicos que demuestran que las personas con hábitos de vida menos saludables, incluidos el tabaco y una alimentación poco equilibrada, usan con menor frecuencia los servicios clínicos preventivos relacionados con la alimentación y así se detectan con menor frecuencia factores de riesgo cardiovascular que podrían ser corregidos, como la hipertensión arterial y la dislipemia, los cuales también están asociados al tabaco y a una alimentación inadecuada.
Los síndromes de deficiencia nutricional que comprometen los micronutrientes en general evolucionan a través de tres estadios: al principio, debido a que la mayoría de los micronutrientes se almacenan en los tejidos, una reducción temporal en la ingesta que se puede compensar mediante una disminución de los depósitos corporales. El segundo estadio comprende alteraciones metabólicas sin síntomas, mientras que sólo la depleción grave (tercer estadio) cursará al final con signos y síntomas clínicos claros, por ello, en el tabaquismo ciertas deficiencias en micronutrientes muchas veces no se detectan hasta que las deficiencias no se presentan combinadas con otros problemas de salud que suponen una mayor demanda de vitaminas u oligoelementos.
Deficiencias funcionales relacionadas con el déficit de micronutrientes
La nutrición es un determinante de la respuesta inmune y la malnutrición es la causa más común de inmunodeficiencia. El cinc, selenio, hierro, cobre, las vitaminas A, C, E, B6 y el ácido fólico tienen también una importante influencia sobre la respuesta inmune. Algunos componentes del humo del cigarrillo promueven la oxidación y proporcionan altos niveles de estrés oxidativo; las necesidades de micronutrientes antioxidantes que se encuentran en los alimentos (vitaminas C, A, E, selenio, cobre, cinc, manganeso) se ven incrementadas y su disponibilidad se ve adversamente afectada en las personas fumadoras y en los fumadores pasivos. Fumar cigarrillos se ha asociado con aumentos de la incidencia y la gravedad de varias enfermedades incluyendo la arteriosclerosis, el cáncer y la enfermedad pulmonar obstructiva crónica.
Por otra parte, es posible que el estímulo suprarrenal prolongado aumente la necesidad de vitamina C, que es necesaria para la producción de catecolaminas. De este modo, la vitamina C en los fumadores se agotaría más rápidamente si no se compensa con una mayor ingestión. La vitamina C es la sustancia antioxidante principal presente en el líquido de la superficie de las vías aéreas del pulmón, donde podría ser importante en la protección frente a oxidantes endógenos y exógenos. Se ha explorado la posible influencia de antioxidantes, especialmente vitamina C, en correlación con el asma, sugiriéndose que una deficiencia de esta vitamina en la dieta es un factor de riesgo.
Fumar disminuye los niveles plasmáticos de vitamina C y de ß-caroteno. En general, el estado nutricional de los fumadores puede deteriorarse por una alimentación inadecuada ya que habitualmente consumen menos frutas y verduras ricas en vitamina C y carotenos.
En relación con la vitamina E, es el principal antioxidante lipófilo, puede disminuir hasta niveles subóptimos en los tejidos de las personas fumadoras, y se ha asociado su deficiencia con el aumento del riesgo cardiovascular.
Los fumadores tienen también niveles séricos más bajos de diversas vitaminas del grupo B (tiamina, riboflavina, vitamina B12 y ácido fólico), así como de algunos minerales: calcio, hierro, yodo y magnesio.
El humo del cigarrillo afecta al sentido gustativo. Se ha llegado a la conclusión de que el humo del tabaco tiene cierta influencia sobre el gusto amargo. En un estudio en el que se investigó el umbral de detección y de identificación en treinta fumadores, para el ácido cítrico, la quinina, el cloruro de sodio y la sacarosa, la conclusión fue que los fumadores sufren un aumento en el umbral de identificación de la quinina y de la detección e identificación del cloruro de sodio.
Referencias
Akbartabartoori M, Lean ME and Hankey CR. Relationships between cigarette smoking, body size and body shape. Int J Obes (Lond) 29: 236-243, 2005.
Ayaori M, Hisada T, Suzukawa M, Yoshida H, Nishiwaki M, Ito T, Nakajima K, Higashi K, Yonemura A, Ohsuzu F, Ishikawa T and Nakamura H. Plasma levels and redox status of ascorbic acid and levels of lipid peroxidation products in active and passive smokers. Environ Health Perspect 108: 105-108, 2000.
Barone J, Taioli E, Hebert JR and Wynder EL. Vitamin supplement use and risk for oral and esophageal cancer. Nutr Cancer 18: 31-41, 1992
Oliver A, Navarro A, et al. Report of the Scientific Committee of the Spanish Food Safety Agency on the impact of Tobacco consumption on feeding and nutrition. Revista del comité científico. 2006.

Deficiencias nutricionales relacionadas con el consumo de alcohol
Cuando se consume en exceso, el alcohol puede interferir gravemente con el estado nutricional del bebedor, ya sea alterando la ingestión del alimento, su absorción o la utilización de los nutrientes por el organismo. Además, el alcohol puede ejercer ciertos efectos nocivos en el hígado directamente o través de los compuestos intermedios resultantes de su metabolismo
Su contenido primario es agua, alcohol puro (etanol) y cantidades variables de azúcares, mientras que las proporciones de proteínas, vitaminas o minerales son irrelevantes o nulas; por tanto, todo el posible aporte calórico proviene de los azúcares y del propio alcohol.
Las calorías derivadas del alcohol poseen menor valor biológico que las procedentes de los hidratos de carbono, sugiriendo que parte de la energía contenida en el alcohol puede perderse o desaprovecharse en el sentido de que no es útil para producir o mantener masa corporal.
También el alcohol puede dañar las mitocondrias y este daño se acompaña de desgaste energético durante el proceso metabólico de las grasas.
Los alcohólicos normalmente no suelen llevar una dieta equilibrada, además de que pueden sufrir alteraciones en cuanto a la absorción y el aprovechamiento de los nutrientes. Por tanto, no es raro que estos pacientes sufran malnutrición primaria o secundaria. La malnutrición primaria ocurre cuando el alcohol reemplaza a otros nutrientes de la dieta, con lo que su ingestión total se reduce; la malnutrición secundaria ocurre cuando el aporte de nutrientes es adecuado, pero el alcohol interfiere con su absorción en el intestino delgado.
El estado malnutricional más grave, asociado a una significativa reducción de la masa muscular, se encuentra en los pacientes que ingresan en un hospital debido a que presentan complicaciones clínicas de su alcoholismo como, por ejemplo, hepatopatía crónica o pancreatitis. La persistencia en la ingestión de etanol comporta una pérdida adicional de peso, mientras que la abstención se asocia a una mejoría del estado nutricional y ganancia de masa muscular; este patrón es común a todos los pacientes alcohólicos.
Hay que destacar la existencia de pacientes que ingieren cantidades exageradas de alcohol y que, al mismo tiempo, hacen una dieta con alto contenido en grasas y además llevan una vida sedentaria; al contrario que malnutrición, tienden a presentar una obesidad central o troncular, es más común que este patrón se observe en mujeres.
Los efectos nocivos de la ingestión abundante de alcohol se reflejan principalmente sobre el metabolismo proteico y de diferentes vitaminas.
Aminoácidos y proteínas: Son indispensables para el mantenimiento de la estructura celular, participan en el transporte de distintas sustancias y actúan como enzimas mediadoras en casi todas las reacciones bioquímicas celulares. Los aminoácidos esenciales se adquieren a través de la dieta. Se sabe que el alcohol interfiere con la captación de estos aminoácidos esenciales.
Las consecuencias clínicas, potencialmente graves, son las siguientes: 1) Hipoalbuminemia, con alteraciones del transporte de ciertos minerales y posible acumulación de líquido (retención hidrosalina); 2) Hipoprotrombinemia y déficit de síntesis de otros factores de la coagulación, con riesgo de hemorragias digestivas o de otros órganos; 3) Reducción de la síntesis de urea, con aumento de la concentración sanguínea de amoniaco y riesgo de desarrollar encefalopatía hepática, y 4) Alteración del balance de aminoácidos, con incremento de los niveles de los aromáticos y riesgo de encefalopatía hepática.
Es habitual que los pacientes alcohólicos, con o sin hepatopatía secundaria, presenten alteraciones clínicas o bioquímicas asociadas al déficit de ciertas vitaminas, principalmente tiamina (B1), riboflavina (B2) y piridoxina (B6), además de ácido ascórbico (vitamina C), ácido fólico y retinol (vitamina A). Se deben tanto a una ingestión reducida con la dieta como al déficit de absorción de vitaminas por el intestino.
La deficiencia de vitamina A comporta dificultad del ojo para acomodarse a los ambientes oscuros (hemeralopía o ceguera nocturna). El exceso de vitamina A en el hígado puede promover la activación de todos los procesos implicados en la fibrogénesis y síntesis de otras proteínas de matriz extracelular, determinando que la formación de cicatriz difusa conlleve el riesgo de generar una cirrosis hepática.
Estudios en humanos, primates y roedores han demostrado que el abuso de alcohol puede ser nocivo para el hígado incluso en casos de nutrición excelente.
Los alcohólicos crónicos ingieren habitualmente aportes insuficientes de carbohidratos, proteínas, grasas, vitaminas A, C y B (especialmente tiamina) y minerales como calcio y hierro. A su vez, las deficiencias de estos nutrientes exacerban los efectos nocivos del alcohol. Por tanto, es decisivo que a estos pacientes se les aporte una dieta completa y equilibrada, suprimiendo como es obvio la ingestión de etanol, y se añadan suplementos dietéticos; por ejemplo, vitamina B1, B2 y B6 a las dosis habituales. Tanto el ácido fólico como la vitamina A deben suplementarse en el caso de que se demuestren deficiencias.
Referencias
Lieber CS. Alcohol: Its metabolism and interaction with nutrients. Ann Rev Nutr 2000; 20:395-430.
Moreno Otero R, Cortés JR. Nutrición y alcoholismo crónico. Nutr Hosp. 2008;23(Supl. 2):3-7.

SÍNDROME PREMENSTRUAL Y FITOTERAPIA
El ciclo menstrual femenino, llamado también ciclo ovárico, comprende el conjunto de cambios fisiológicos y periódicos que afectan a su aparato genital y a todo su organismo. Son cambios que tienen lugar en torno al fenómeno de la ovulación, con el fin de crear en la mujer las condiciones morfológicas y fisiológicas óptimas para la fecundación.
El síndrome premenstrual (SPM), denominado también tensión premenstrual, es un trastorno recurrente que suele ser acompañado por dolores menstruales. Engloba al conjunto de síntomas molestos y repetitivos, que pueden presentar la mayoría de las mujeres con mayor o menor intensidad, unos días antes de la regla (de 1 a 2 semanas antes de la menstruación). Aunque esto es lo más habitual, estos síntomas también podrían prolongarse y continuar durante la menstruación, desapareciendo completamente después de ésta.
Síntomas
Existen más de 150 posibles síntomas asociados al SPM, y aunque casi todas las mujeres presentan algún síntoma premenstrual (alrededor de un 80%), éstos pueden variar mucho en su intensidad de una mujer a otra. En un 30% de ellas, estos síntomas son moderados (han de tomar alguna medicación para aliviarlos), y sólo en un 5-10% de las mujeres son lo suficientemente graves como para impedirles realizar su actividad diaria normal, perjudicándoles en su trabajo, en su estilo de vida o en las relaciones interpersonales. Estas mujeres presentan entonces desorden disfórico premenstrual, que es el grado grave del síndrome premenstrual.
La manifestación más común del SPM es la alteración del ánimo que se traduce en síntomas de depresión o irritabilidad, insomnio, fatiga, dificultad en la concentración, etc. Por otro lado, también es muy característica la retención de líquidos que puede producir mastalgia (dolor en los senos), distensión abdominal, aumento transitorio de peso y disminución en la cantidad de orina producida.
Pero además hay otros síntomas, no menos importantes, como los dolores de cabeza, acné, mareos, calambres (parestesias) en las piernas, pequeños hematomas en la piel de los brazos y piernas, sensación de palpitaciones cardíacas, estreñimiento, ardor en el estómago, náuseas, vómitos, cambios del apetito (normalmente se da una disminución del apetito) y manía por comer alimentos específicos (sobre todo, se produce un deseo insaciable de azúcar).
Causas
Puede que no haya una causa única dada la diversidad de síntomas, pero su aparición está relacionada con los cambios hormonales que acontecen tras la ovulación.
Medidas preventivas
No existen unas medidas específicas y eficaces de prevención del SPM, aunque, sí existen medidas sencillas, que pueden disminuir la intensidad de los síntomas:
- Seguir una dieta equilibrada, variada, rica en frutas, vegetales, cereales integrales y legumbres, y pobre en grasa saturada.
- Comer pequeñas cantidades con intervalos más cortos de tiempo (de 4 a 5 comidas diarias).
Asegurar el aporte suficiente de vitamina B6, vitamina E, magnesio, calcio y ácidos grasos esenciales. - Disminuir el consumo de azúcares, evitar el consumo de tabaco y alcohol, y reducir el de cafeína y otras bebidas estimulantes (café, té, chocolate, bebidas de cola).
- Es recomendable disminuir el consumo de sal, ya que su consumo excesivo puede producir retención de líquidos en los tejidos, lo que agrava el síndrome premenstrual.
Evitar situaciones de estrés, tanto familiar como laboral en los días previos a la menstruación. Para ello es muy útil practicar algún método de relajación: yoga, meditación o ejercicios de respiración, y practicarlos siempre que sea necesario. - Realizar ejercicio físico suave y regularmente en los días previos a la menstruación. Ya que parece tener un efecto positivo sobre los síntomas de retención de líquidos.
Aunque el síndrome premenstrual es un trastorno muy habitual, si los síntomas son muy graves, debe remitirse la paciente a su ginecólogo.
Tratamiento fitoterapéutico
La fitoterapia también puede resultar útil en el tratamiento del síndrome premenstrual. Entre las especies que se han demostrado más útiles se encuentran el sauzagatillo o agnocasto (Vitex agnus castus), la matricaria (Tanacetum parthenium) y el aceite de onagra (Oenothera biennis).
Sauzgatillo
Su principal acción farmacológica es su contribución en la mejora sintomatológica del SPM, debido a su efecto modificador del equilibrio estrógenos/progestágenos a favor de los progestágenos (acción antiestrogénica). Esto es consecuencia, tanto de su capacidad de inhibición hipofisaria de la hormona folículo estimulante (FSH) como de la de estimulación hipofisaria de la hormona luteinizante (LH), frenando la secreción de prolactina. También tiene acción sedante suave.
Su uso está indicado, principalmente, para el tratamiento del SPM.
Matricaria
No se recomienda su uso durante un período prolongado o dosis mayores a las recomendadas, debido a su posible neurotoxicidad.
Su efecto farmacológico principal es como analgésico y antiinflamatorio, por lo que, tradicionalmente se ha utilizado para el tratamiento de cefaleas, amenorrea, oligomenorrea, SPM, etc.
Contraindicaciones: hipersensibilidad a la matricaria o a otras especies de la familia de las compuestas, embarazo o lactancia.
Onagra
De esta especie, se obtiene un aceite con una gran riqueza en ácidos grasos insaturados, entre los que destacan el ácido linoleico y el ácido g-linolénico, precursores ambos de determinadas prostaglandinas antiinflamatorias.
Se utiliza en el tratamiento de la mastalgia cíclica (dolor cíclico mamario), síntoma que presentan en diversos grados más del 50% de las mujeres en edad reproductora durante la segunda mitad del ciclo menstrual.
La administración debe realizarse durante la segunda quincena del ciclo menstrual.
Referencias
López Luengo MT. Síndrome premenstrual. Elsevier. 2004; 23 (11): 92-95.
Arteche A, Vanaclocha B, Güenechea JL. Fitoterapia (3.ª ed.). Vademécum de prescripción. Plantas medicinales. Barcelona: Masson, 1998.

FASES DEL CICLO MENSTRUAL Y SU RELACIÓN CON LA ACT FÍSICA
La división del ciclo menstrual en cinco fases depende de las características de los cambios hormonales, fisiológicos y se encuentra en correspondencia con la influencia que éstas pueden causar a la actividad física, estas son:
Fase I (fase menstrual): abarca alrededor de los primeros cuatro días del ciclo (primero al cuarto) donde normalmente se producen alteraciones más o menos intensas que se caracterizan por perturbaciones psicológicas, cansancio y malestar general referido comúnmente como síndrome premenstrual que puede abarcar tanto la fase premenstrual como la menstrual. Algunos de los cambios encontrados en diversas investigaciones son: dismenorreas, cefaleas, vómitos, diarreas o cólicos menstruales en algunas atletas, debido a la influencia de prostaglandinas, lo que disminuye las capacidades físicas de deportistas de alto rendimiento durante esta etapa.
Existe un incremento de la frecuencia cardiaca, lo que se refleja en la recuperación de la actividad física; así como un aumento de la presión arterial mínima y un aumento de la glucosa sanguínea. Por lo tanto, se recomienda bajar la carga de entrenamiento según el comportamiento individual hasta lograr una adaptación a su problema orgánico sobre todo el primer día.
La pérdida de sangre que es característico en esta fase, provoca en el organismo la disminución en los índices de hemoglobina y con ello del transporte de oxígeno en el cuerpo, de manera esencial en los músculos, donde se encuentra pérdidas de 1,2 mg a 2 mg por día de hierro donde hay variaciones en la hemoglobina durante todo el ciclo; es por ello que no es recomendable realizar actividades físicas que lleven a altos consumos de oxígeno puesto que influye en la disminución de las posibilidades de trabajo del organismo.
En esta etapa además ocurren otros cambios fisiológicos que afectan la actividad física: aumento de la frecuencia cardiaca en recuperación y en reposo, déficit en el transporte de oxígeno por la disminución de hemoglobina en sangre, etc. Cambios psicológicos que afectan la actividad física: apatía, indiferencia, cansancio, entre otros.
Por tanto, los contenidos de entrenamiento recomendados para trabajar en esta fase son: aeróbico y fuerza y la dinámica del volumen y la intensidad del trabajo físico debe oscilar en medio (40 – 60 %), con el objetivo de mantener el nivel de entrenamiento adquirido.
Fase II (fase posmenstrual): abarca de siete a nueve días posteriores (quinto al doceavo) es también llamada la fase estrogénica y en esta etapa mejora el rendimiento por aumento de la producción de estrógenos y progesterona, determinantes en el desempeño de las deportistas. Por tanto, al final de los días de la menstruación la mujer se encuentra llena de energía y le resulta más fácil entrenar y realizar series de alta intensidad durante tiempos cortos, lo que recurre al glucógeno muscular como sustrato energético; mientras que al ovular y durante los días de la fase lutéica, los niveles de estrógeno son más elevados lo que hace sentir a la atleta menos rápida pero más cómoda parar entrenar resistencia.
Los cambios psicológicos que afectan la actividad física son: mayor sensibilidad propioceptiva y estado psicológico óptimo, por tanto, los contenidos de entrenamiento recomendados para trabajar en esta fase son: fuerza explosiva (se puede aumentar cargas), resistencia media, resistencia larga y rapidez, y la dinámica del volumen y la intensidad del trabajo físico: 60-75 %.
Fase III (fase de ovulación): comprende alrededor de cuatro días del ciclo (treceavo al dieciseisavo) en dicha fase se encuentra el día 14 donde ocurre la ovulación, se desprende el óvulo del ovario y representa el día más fértil de la mujer; lo que disminuye de forma considerable las hormonas: luteinizante, estradiol y folículo estimulante, por el contrario, la progesterona se incrementa y desciende el día 28. Esta fase da inicio a la fase lutéica. El recubrimiento espeso del endometrio sigue alto, sensible a la progesterona, al aumento de enzimas y los tejidos glandulares producen secreciones, por lo que se cubre de materiales ricos en glucógeno, proteínas, lípidos y enzimas.
Los cambios fisiológicos que afectan la actividad física son: mayores indicadores de volumen respiratorio por minuto, aumento de temperatura corporal en un grado centígrado alrededor de 36°C a 37°C.
La dinámica del volumen y la intensidad del trabajo físico son: 40 % al 60 %.
Fase IV (fase de posovulación): tiene una duración de siete a nueve días (décimo séptimo al vigésimo cuarto día) aumenta la temperatura corporal a 37°C y la progesterona y el estradiol vuelven a aumentar sus concentraciones, disminuyen la hormona luteinizante y el folículo estimulante.
El aumento de la producción de estrógenos y progesteronas son determinantes en el desempeño de las deportistas de alto rendimiento al aumentar la fuerza, resistencia y velocidad.
Los cambios fisiológicos que afectan la actividad física son el aumento del VO2 Máx. Los cambios psicológicos incluyen una mayor sensibilidad propioceptiva y estado psicológico óptimo.
Los contenidos de entrenamiento recomendados para trabajar en esta fase: fuerza, resistencia, velocidad. Dinámica del volumen y la intensidad del trabajo físico: del 60-75 %.
Fase V (fase premenstrual): comprende de tres a cinco días del ciclo (vigésimo quinto al vigésimo octavo día), considerado como la peor fase para entrenar puesto que es la más pobre en cuanto a asimilación de carga se refiere, debido a la presencia de una alta concentración de progesterona, puesto que esta hormona es catabólica y perjudica el rendimiento físico.
Las atletas se muestran irritadas, impacientes y nerviosas en los entrenamientos debido al aumento de índices de hormonas como las catecolaminas, la adenocorticotrófica (ACTH) y el cortisol relacionadas a la percepción de la dificultad del ejercicio, reducción en la capacidad de concentración y fatiga muscular, además de la acción del síndrome premenstrual que se acompaña de dolores abdominales, desequilibrio psicológico, malestares generales, falta de disposición entre otros.
Los cambios fisiológicos que afectan la actividad física incluyen la disminución del VO2 Máx, el aumento de la frecuencia cardiaca y la aparición en algunas mujeres del síndrome premenstrual. Los cambios psicológicos son disminución de la concentración de la atención, aumento de la percepción de la fatiga y aumento de las tensiones psíquicas.
Los contenidos del entrenamiento recomendados para trabajar en esta fase son: trabajo de fuerza, evitar el trabajo de velocidad. Dinámica del volumen y la intensidad del trabajo físico: 40-60 %.
La contribución de los cambios tan divergentes de cada fase, dependen de factores endógenos, exógenos y psíquicos dentro del marco del ciclo menstrual que permiten introducir el modelo de entrenamiento de la mujer.
Referencias
Aguilar Macías AS, et al. La mujer, el ciclo menstrual y la actividad física. Scielo. 2017;21(2).
Joyner MJ. Physiological limits to endurance exercise performance: influence of sex. J Physiol. 2016; 28;00:00.

Monohidrato de creatina
La creatina es uno de los suplementos nutricionales más estudiados de todos los tiempos, incluyendo la investigación sobre su eficacia y seguridad en poblaciones saludables, atletas, ancianos y pacientes. Los efectos de mejora del rendimiento durante el ejercicio breve e intenso, así como en el entrenamiento de fuerza han sido bien documentados.
Debido a que la captación de creatina muscular es mediada por insulina, ésta puede incrementarse aún más ingiriendo suplementos de creatina con nutrientes insulinogénicos como carbohidratos, combinaciones de carbohidratos/proteínas.
El rendimiento en ejercicios de alta intensidad que duran menos de 30” generalmente mejora después de la suplementación con creatina. Este efecto beneficioso parece ser más evidente cuando hay episodios repetidos de ejercicio intenso, con las excepciones de correr, pedalear y nadar. Cuanto mayor sea la duración del ejercicio sobre los 30”, menos probable será que los suplementos de creatina tengan un efecto ergogénico, o posiblemente un efecto estadísticamente medible.
No se conoce la dosis exacta de creatina para aumentar al máximo la creatina muscular, pero la mayoría de los estudios han seguido un protocolo a corto plazo de dosis altas (20 g/día durante 5 días) o un protocolo a largo plazo de dosis más bajas (3-5 g/día durante 30 días) para alcanzar la saturación de creatina muscular.
Solo pequeñas cantidades de creatina de la dieta o de suplementos (3-5 g/día) parecen necesarias para mantener los niveles elevados de creatina muscular durante el tiempo que se desee.
El exceso de creatina a partir de suplementos, que no se absorbe por los tejidos, se excreta en la orina. El factor que determina la magnitud del aumento de la creatina muscular en respuesta a la suplementación parece ser la creatina muscular inicial; aquellos con niveles basales bajos tendrán los mayores incrementos con la suplementación.
Beneficios
Aumento de la fuerza, la resistencia muscular y la masa magra, debido a la mayor calidad del entrenamiento de fuerza y acondicionamiento, puede traducirse en un mejor rendimiento deportivo.
Las adaptaciones musculares asociadas a la suplementación con creatina pueden mejorar las respuestas al entrenamiento y la recuperación en un período de inactividad (durante la rehabilitación de una lesión).
La preocupación por la seguridad de la creatina puede enfocarse en situaciones de función renal alterada, disfunción muscular o deterioro en la termorregulación. Según los datos de ensayos clínicos, no hay pruebas de que la ingesta de suplementos de creatina a las dosis recomendadas afecte los procesos renales, musculares o termorreguladores.
Referencias
Eric. S. Rawson. The Safety and Efficacy of Creatine Monohydrate Supplementation: What we have learned from the Past 25 Years of Research.. Sports Science Exchange (2018) Vol. 29, No. 186, 1-6.
Rawson, E.S., M.P. Miles, and D. E. Larson-Meyer (2018). Dietary supplements for health, adaptation, and recovery in athletes.Int. J. Sport Nutr. Exerc. Metab. 28:188-199.

La cafeína y sus efectos en el deporte
La cafeína puede ser el “suplemento” más estudiado sobre el planeta. Se ha demostrado que es “ergogénico” o que “aumenta el rendimiento”, razón por la cual se consume mundialmente en una variedad de escenarios sociales y deportivos, además fue eliminado de la lista restringida de la Agencia Mundial Antidopaje en 2004.
La hipótesis inicial fue metabólica y explica los efectos ergogénicos de la cafeína durante el ejercicio de resistencia: aumento de los niveles de catecolaminas y la lipólisis del tejido adiposo, aumento resultante de ácidos grasos libres (AGL) circulantes tomados y oxidados por los músculos activos, para ahorrar reservas de glucógeno muscular para uso posterior en el ejercicio, resultando en un tiempo de trabajo hasta el agotamiento prolongado.
En muchos estudios usando dosis moderadas a altas de cafeína (5-9 mg/kg MC) se reportaron efectos ergogénicos en actividades de resistencia y efectos pronunciados sobre las respuestas fisiológicas al ejercicio, incluyendo aumento de la frecuencia cardiaca, duplicación de los niveles de catecolaminas, mayores niveles de lactato en sangre y también aumento de los niveles de AGL y glicerol en sangre en algunos sujetos. Estas dosis también produjeron algunos efectos secundarios problemáticos, incluyendo malestar gastrointestinal, nerviosismo, confusión mental, inhabilidad de concentrarse y alteraciones del sueño. Sin embargo, la administración de dosis más bajas de cafeína (3 mg/kg MC, ~200 mg) también produjeron un efecto ergogénico con distintos incrementos en las concentraciones de cafeína en plasma, pero sin cambios en las respuestas fisiológicas al ejercicio y pocos, o ningún efecto secundario.
En varios estudios recientes se ha demostrado que dosis más bajas de cafeína tienen efectos ergogénicos cuando se dan antes del ejercicio en eventos de resistencia cortos y más prolongados, ejercicios de fuerza y resistencia muscular, deportes intermitentes de equipo como el baloncesto, voleibol, futbol, rugby, hockey sobre césped, así como deportes individuales como la natación, golf y tenis.
En la mayoría de la bibliografía se ha reportado que no hay efecto ergogénico sobre el rendimiento en el ejercicio aeróbico.
La cafeína puede administrarse en cápsulas, café, bebidas deportivas y energéticas, gomas de mascar, geles, barras y tiras bucales solubles con efectos ergogénicos. El enjuague bucal con cafeína o administración de cafeína en aerosol es menos probable que produzca un efecto ergogénico. Sin embargo, se ha demostrado que el enjuague bucal con cafeína mejora esfuerzos repetidos de sprint y pateo de corta duración y alta intensidad en estados de glucógeno muscular normal o agotado.
Los efectos ergogénicos de la cafeína generalmente son independientes del uso de cafeína habitual, nivel de entrenamiento, consumo dietético, género, nivel de hidratación y modalidad de ejercicio.
Al considerar si se debe utilizar cafeína como una ayuda ergogénica potencial, los atletas deben iniciar con dosis bajas de cafeína de ~100-200 mg (~1.5-3 mg/kg MC). Las dosis más altas no parecen otorgar ventajas adicionales.
Referencias
Lawrence L. Spriet, PhD. Cafeína y rendimiento deportivo: una actualización. Sports Science Exchange (2020) Vol. 29, No. 203, 1-6.
Burke, L.M. (2008). Caffeine and sports performance. Appl. Physiol. Nutr. Metab. 33:1319–1334.
Burke, L., B. Desbrow, and L. Spriet (2013). Caffeine for sports performance. Human Kinetics, Champaign, Illinois, USA.

¿Consumir BCCAs genera algún beneficio en el entrenamiento?
Introducción
Los suplementos de aminoácidos de cadena ramificada (BCAAs, por sus siglas en inglés) son tres: leucina, isoleucina y valina. Son aminoácidos esenciales, es decir, sustancias que debemos aportar mediante la dieta ya que nuestro organismo no los fabrica de forma endógena o autónoma. Y son consumidos principalmente por atletas, pero también por población activa que practica actividad física, ejercicio físico y/o deporte de forma recreacional.
Algunos de los motivos por los cuales se toman los suplementos son para ayudar a la recuperación del entrenamiento, el mantenimiento o mejora de la salud, la mejora del rendimiento, mejorar funciones inmunes, etc., sin embargo, la toma de suplementos sin una garantía de calidad del producto, pueden suponer un riesgo para la salud.
Son muchas las fuentes por las cuales la población obtiene información y adquiere los suplementos nutricionales: familiares, amigos, publicidad (como revistas o medios online), compañeros de equipo y entrenadores. Además de las mencionadas con anterioridad, los atletas profesionales acostumbran a obtener esta información por otras fuentes como nutricionistas, médicos, farmacéuticos o fisioterapeutas.
Debido a que teóricamente existe una participación de los suplementos de BCAAs en el metabolismo energético en entrenamiento de fuerza, cada vez son más los suplementos de nutrición deportiva que incorporan en su fórmula BCAAs para incidir en los efectos anteriormente mencionados. Sin embargo, no se ha establecido una dosis y posología exacta ni sus efectos positivos en el individuo. La Agencia Europea de Seguridad Alimentaria (EFSA), en 2010, emitió un informe sobre las declaraciones nutricionales y de propiedades saludables relacionando los BCAAs con el crecimiento y mantenimiento de la masa muscular, atenuación de la disminución de la masa muscular en deportes de altitud, mayor rapidez de recuperación de la fatiga después del ejercicio, mejora de la función cognitiva después del ejercicio, reducción del esfuerzo percibido durante el ejercicio y sistema inmunitario saludable.
Desarrollo
Uno de los mecanismos más interesantes que explicaría la disminución de la fatiga es el consumo de BCAAs, ya que pueden actuar como un neurotransmisor per se. Su ingesta aumenta las concentraciones en plasma de este tipo de aminoácidos y previene el aumento de la ratio de triptófano libre/BCAAs y, por lo tanto, el transporte y absorción de triptófano dentro del cerebro. Esto reduciría la síntesis, la concentración y la liberación del neurotransmisor 5-hidroxitriptamina (5-HT), que está directamente relacionado con el desarrollo de la fatiga central y consecuentemente con la reducción del rendimiento.
Babault y Cols. indican que, con una ingesta aguda de proteínas, después de 4 sesiones de entrenamiento y una toma de 42g de una mezcla de proteínas patentada (aislado de proteína de suero de leche, aislado de caseína y 250mg de BCAAs), ingeridas antes y después del ejercicio: mostraban mejoras significativas en la recuperación del rendimiento, siendo capaces de realizar más repeticiones que el grupo placebo. Sin embargo, en otro estudio similar no lograron encontrar ningún efecto significativo entre los grupos experimentales y control en la reducción de la fatiga.
El estudio de Kirby y Cols. muestra que suplementar con una cantidad determinada de leucina y con una temporización específica no proporciona efectos protectores de atenuación en los marcadores bioquímicos de daño muscular (creatina quinasa [CK] y mioglobina [Mb]) después de realizar ejercicios excéntricos de fuerza, como tampoco evita que el dolor muscular en los grupos experimentales disminuya durante las 96 horas postejercicio. En cambio, Howatson y Cols. indican que después de la toma de un suplemento de 10g de BCAAs el daño muscular y el dolor muscular a las 24 y 48 horas postejercicio disminuyen significativamente en comparación a un placebo.
Las últimas investigaciones realizadas sobre los efectos de los suplementos de BCAAs sobre la ganancia de fuerza, sugieren que la suplementación no ayuda a su mejora como tampoco a la mejora de otros parámetros relacionados con el rendimiento deportivo. Aun así, sí se observaban mejoras en el aumento de la fuerza, el tamaño muscular y otros aumentos en parámetros de rendimiento (como la resistencia muscular) debido al entrenamiento de la fuerza. De esta forma, es posible que los efectos por sí solos del entrenamiento, según lo observado en los grupos control y/o placebo, puedan enmascarar los posibles beneficios del suplemento de BCAAs. Sin embargo, Willoughby y Cols. mostraron que pasadas 10 semanas de un programa de entrenamiento de fuerza a alta intensidad, combinado con la ingesta de 20g de proteína (14g de suero de leche y caseína y 6g de aminoácidos), 1 hora antes y después del ejercicio, es más eficaz que un suplemento placebo (20g de dextrosa) en la mejora de la fuerza muscular y el rendimiento. Tal y como ya se ha apuntado con anterioridad, probablemente los cambios en los parámetros de fuerza se deban a factores neurológicos que hacen incrementar la fuerza después de un programa de entrenamiento y no a los suplementos de BCAAs. Así, Folland y Col. indican que dentro de las 2 primeras semanas de entrenamiento ya surgen cambios neurológicos que pueden ser debidos al aprendizaje de la técnica de los ejercicios y a cambios en la coordinación intermuscular de músculos agonistas, antagonistas y sinergistas.
Conclusión
La leucina sí tiene efecto sobre la masa muscular y su función en población de edad avanzada con sarcopenia, así como también efectos positivos en ciertos parámetros corporales en población joven. Bajas tomas de proteína con 5g de leucina, inmediatamente después del ejercicio, pueden ser igual de eficaces que dosis altas de proteína para estimular el aumento de las tasas de síntesis de proteínas musculares y conseguir los mismos resultados de anabolismo muscular.
Por lo tanto, sí puede haber un efecto positivo con ciertas ingestas de BCAAs para atenuar el dolor y daño muscular (CK y Mb), así como interferir positivamente en ciertos parámetros de rendimiento relacionados con la fuerza.
Sin embargo, faltan datos más rigurosos y precisos sobre la respuesta anabólica y la fatiga central, así como qué protocolo de suplementación es más eficaz y seguro.
Referencias
Jordi Rabassa-Blanco, Imma Palma-Linares. Effects of protein and branched-chain amino acids supplements in resistance training: a review. Rev Esp Nutr Hum Diet. 2017; 21(1).
Babault N, Deley G, Le Ruyet P, Morgan F, Allaert FA. Effects of soluble milk protein or casein supplementation on muscle fatigue following resistance training program: a randomized, double-blind, and placebo-controlled study. J Int Soc Sports Nutr. 2014; 11:36.
Willoughby DS, Stout JR, Wilborn CD. Effects of resistance training and protein plus amino acid supplementation on muscle anabolism, mass, and strength. Amino Acids . 2007; 32(4): 467-77.
Folland JP, Williams AG. The adaptations to strength training: morphological and neurological contributions to increased strength. Sports Med. 2007; 37(2): 145-68.
Kirby TJ, Triplett NT, Haines TL, Skinner JW, Fairbrother KR, McBride JM. Effect of leucine supplementation on indices of muscle damage following drop jumps and resistance exercise. Amino Acids . 2012; 42(5): 1987-96.
Howatson G, Hoad M, Goodall S, Tallent J, Bell PG, French DN. Exercise-induced muscle damage is reduced in resistance-trained males by branched chain amino acids: a randomized, double-blind, placebo controlled study. J Int Soc Sports Nutr . 2012; 9: 20.

Monohidrato de creatina
La creatina es uno de los suplementos nutricionales más estudiados de todos los tiempos, incluyendo la investigación sobre su eficacia y seguridad en poblaciones saludables, atletas, ancianos y pacientes. Los efectos de mejora del rendimiento durante el ejercicio breve e intenso, así como en el entrenamiento de fuerza han sido bien documentados.
Debido a que la captación de creatina muscular es mediada por insulina, ésta puede incrementarse aún más ingiriendo suplementos de creatina con nutrientes insulinogénicos como carbohidratos, combinaciones de carbohidratos/proteínas.
El rendimiento en ejercicios de alta intensidad que duran menos de 30” generalmente mejora después de la suplementación con creatina. Este efecto beneficioso parece ser más evidente cuando hay episodios repetidos de ejercicio intenso. Con las excepciones de correr, pedalear y nadar. Cuanto mayor sea la duración del ejercicio sobre los 30”, menos probable será que los suplementos de creatina tengan un efecto ergogénico, o posiblemente un efecto estadísticamente medible.
No se conoce la dosis exacta de creatina para aumentar al máximo la creatina muscular, pero la mayoría de los estudios han seguido un protocolo a corto plazo de dosis altas (20 g/día durante 5 días) o un protocolo a largo plazo de dosis más bajas (3-5 g/día durante 30 días) para alcanzar la saturación de creatina muscular.
Solo pequeñas cantidades de creatina de la dieta o de suplementos (3-5 g/día) parecen necesarias para mantener los niveles elevados de creatina muscular durante el tiempo que se desee.
El exceso de creatina a partir de suplementos, que no se absorbe por los tejidos, se excreta en la orina. El factor que determina la magnitud del aumento de la creatina muscular en respuesta a la suplementación parece ser la creatina muscular inicial; aquellos con niveles basales bajos tendrán los mayores incrementos con la suplementación.
Beneficios
Aumento de la fuerza, la resistencia muscular y la masa magra, debido a la mayor calidad del entrenamiento de fuerza y acondicionamiento, puede traducirse en un mejor rendimiento deportivo.
Las adaptaciones musculares asociadas a la suplementación con creatina pueden mejorar las respuestas al entrenamiento y la recuperación en un período de inactividad (durante la rehabilitación de una lesión).
La preocupación por la seguridad de la creatina puede enfocarse en situaciones de función renal alterada, disfunción muscular o deterioro en la termorregulación. Según los datos de ensayos clínicos, no hay pruebas de que la ingesta de suplementos de creatina a las dosis recomendadas afecte los procesos renales, musculares o termorreguladores.
Referencias
Eric. S. Rawson. The Safety and Efficacy of Creatine Monohydrate Supplementation: What we have learned from the Past 25 Years of Research.. Sports Science Exchange (2018) Vol. 29, No. 186, 1-6.
Rawson, E.S., M.P. Miles, and D. E. Larson-Meyer (2018). Dietary supplements for health, adaptation, and recovery in athletes.Int. J. Sport Nutr. Exerc. Metab. 28:188-199.

Ayuno intermitente; una estrategia de pérdida rápida de peso
ABREVIACIONES
GET: gasto energético total
SNC: sistema Nervioso Central
AG: ácidos grasos
SOP: síndrome de ovario poliquístico
DHEA-S: sulfato de dehidroepiandrosterona
SHBG: La globulina fijadora de hormonas sexuales
TRE: alimentación restringida en el tiempo
DM: Diabetes Mellitus
INTRODUCCIÓN
El ayuno intermitente (AI), es un modelo de alimentación que va por ciclos con períodos de ayuno y de alimentación, demanda la realización de restricción de uno o dos días por semana, continuos o alternados, y puede ser total o restringido al 25-30% del GET.
Existen diversas variaciones, entre las principales y más utilizadas están:
– Ayuno durante horas (AH), varía ampliamente, entre 4 y 20 horas, siendo práctica común omitir el desayuno o la cena.
– Ayuno de día completo (ADC), 1 o 2 días de ayuno completo durante la semana.
– Ayuno de día alternado (ADA), alternar días de consumo normal y otros con consumo de 25 a 30 % del GET, por periodos que van desde una a diez semanas.
– Ayuno de día alternado modificado (ADAM), consiente en el consumo de 25-50% del GET en los días de ayuno, seguido de libre acceso a alimento durante los días de realimentación.
– La dieta que imita al ayuno (DIA), la más recientemente denominación, demanda restricción entre 25-50% del GET durante cinco días consecutivos al mes.
No es recomendable hacer ayuno total debido a que la perdida por día de proteínas es de 75 g y de músculo 300 g.
DESARROLLO
La adhesión a intervenciones dietéticas orientadas a la reducción de masa corporal es indispensable para alcanzar el objetivo de pérdida de peso. El hambre y la saciedad son reguladas por el SNC, y dietas restrictivas afectan el control de la homeostasis energética, dificultando el cumplimiento de la dieta debido a los prolongados periodos de restricción alimentaria.
Durante los períodos de ayuno, los triglicéridos se descomponen en ácidos grasos y glicerol, y se usan para la energía debido a la falta de glucosa. El hígado convierte ácidos grasos a cuerpos cetónicos, que proporcionan una fuente principal de energía para muchos tejidos durante el ayuno, especialmente al cerebro. Los niveles de cuerpos cetónicos comienzan a elevarse a las 8 – 12 horas del inicio del ayuno.
Las células adoptan un modo de resistencia al estrés mediante la reducción de la señalización de la insulina y la síntesis general de proteínas. El ejercicio mejora estos efectos del ayuno. Al recuperarse del ayuno (comer y dormir), los niveles de glucosa aumentan, los niveles de cetonas disminuyen significativamente y las células aumentan la síntesis de proteínas, experimentando crecimiento y reparación.
Estos beneficios incluyen mejoras en la regulación de la glucosa, la presión arterial y la frecuencia cardíaca; la eficacia del entrenamiento de resistencia; la pérdida de grasa abdominal, así como la pérdida de peso corporal.
Sin embargo, se puede experimentar hambre, irritabilidad, constipación, retención hídrica, mareos, malestar general y una capacidad reducida para concentrarse durante los períodos de restricción de alimentos al final de ocho semanas de tratamiento. Estos efectos secundarios generalmente desaparecen en 1 mes, lo que se debe informar a los pacientes.
Aplicaciones clínicas del ayuno intermitente:
– Efectos en la salud y el envejecimiento
La ingesta reducida de alimentos aumenta de manera sólida la vida útil. Las intervenciones del ayuno intermitente mejoran la obesidad, la resistencia a la insulina, la dislipidemia, la hipertensión y la inflamación. En comparación con dietas con reducción en la ingesta calórica diaria, el ayuno intermitente se asocia a un mayor aumento en la sensibilidad a la insulina y una mayor reducción en la circunferencia de la cintura.
– Efectos físicos y cognitivos
La función física mejora. El ayuno intermitente durante 16 horas se asocia a pérdida de grasa mientras se mantiene la masa muscular bajo entrenamiento de resistencia. Mejora la cognición global en múltiples dominios, incluida la memoria espacial, verbal, asociativa y de trabajo, así como la función ejecutiva.
– Obesidad
En personas obesas o con sobrepeso favorece la pérdida de peso. Durante el período de alimentación se recomienda una dieta rica en nutrientes. Un ejemplo de este tipo de alimentación es la dieta CRON (Restricción de Calorías con Nutrición Óptima), que se ha asociado con bajas tasas de marcadores de inflamación y estrés oxidativo.
– Enfermedad cardiovascular
Mejora múltiples indicadores de la salud cardiovascular incluida la presión arterial, frecuencia cardíaca en reposo, niveles de colesterol, triglicéridos, lipoproteínas de alta y baja densidad (HDL y LDL), glucosa e insulina y resistencia a la insulina. La mejoría en los indicadores de salud cardiovascular se hace evidentes dentro de 2 a 4 semanas después del comienzo del ayuno en días alternos.
– Trastornos neurodegenerativos
La ingesta energética excesiva, particularmente en la mediana edad, aumenta el riesgo de accidente cerebrovascular, enfermedad de Alzheimer y enfermedad de Parkinson. El ayuno intermitente puede retrasar el inicio y la progresión de los procesos de estas enfermedades.
– Asma, esclerosis múltiple y artritis
La pérdida de peso reduce los síntomas de asma y la resistencia de las vías respiratorias en pacientes obesos. Se asocia con reducciones significativas en los niveles séricos de marcadores de inflamación y estrés oxidativo. En pacientes con esclerosis múltiple el ayuno intermitente se asocia a reducción de síntomas en un período de 2 meses. Debido a que reduce la inflamación, también se esperaría que sea beneficioso en la artritis reumatoide.
Contraindicaciones
– DM tipo 1
– Epilepsia refractaria
– Embarazo
– Lactancia
– Infancia
– Patologías gastrointestinales severas (enfermedad de Crohn, celiaca, síndrome de intestino corto y mala absorción).
Efectos del ayuno intermitente en las concentraciones de hormonas reproductivas
Mujeres:
Los resultados obtenidos del estudio de Harvie et al., ofrecen promesas para el uso del ayuno intermitente en el tratamiento de afecciones hiperandrogénicas como el SOP. Aunque es importante tener en cuenta que estos resultados generalmente solo se observaron cuando el consumo de alimentos se limitó a las primeras horas del día. Por lo tanto, es posible que las mujeres premenopáusicas deban terminar de comer a las 4 p. m. Por otro lado, el ayuno no parece tener ningún efecto sobre otras hormonas reproductivas como el estrógeno, las gonadotropinas y la prolactina.
El ayuno generalmente reduce los andrógenos (es decir, testosterona y FAI) mientras aumenta la SHBG en mujeres premenopáusicas con obesidad y con SOP.
Varones:
La testosterona es la principal hormona esteroide androgénica en los hombres adultos y es responsable de mantener la producción de esperma, la libido y la eficacia sexual. Además, estimula la síntesis de proteínas musculares, aumentando así la masa muscular.
Los resultados obtenidos en un estudio, sugieren que la TRE reduce los niveles de testosterona libre y total en hombres jóvenes delgados y físicamente activos. SHBG, sin embargo, no parece cambiar con TRE, aunque los hallazgos son muy limitados. Curiosamente, la masa muscular y la fuerza muscular no se vieron afectadas negativamente por la reducción de los niveles de testosterona circulante.
CONCLUSIÓN
Es muy importante que el período de alimentación conste de una dieta sana y equilibrada.
El mantenimiento de un régimen de ayuno intermitente, particularmente cuando se combina con ejercicio regular, da como resultado muchas adaptaciones a largo plazo que mejoran el rendimiento mental y físico y aumentan la resistencia a las enfermedades.
REFERENCIAS
De Cabo, R., & Mattson, M. P. (2019). Effects of Intermittent Fasting on Health, Aging, and Disease. New England Journal of Medicine, 381(26), 2541-2551.
Harvie M, Howell A. Potential Benefits and Harms of Intermittent Energy Restriction and Intermittent Fasting Amongst Obese, Overweight and Normal Weight Subjects—A Narrative Review of Human and Animal Evidence. Behav Sci. 2017;7(1):1-22.
Harvie, M.N.; Pegington, M.; Mattson, M.P.; Frystyk, J.; Dillon, B.; Evans, G.; Cuzick, J.; Jebb, S.A.; Martin, B.; Cutler, R.G.; et al.The effects of intermittent or continuous energy restriction on weight loss and metabolic disease risk markers: A randomized trialin young overweight women.Int. J. Obes.2011,35, 714–727.
Cienfuegos, S.; Corapi, S.;Gabel, K.; Ezpeleta, M.; Kalam, F.;Lin, S.; Pavlou, V.; Varady, K.A. Effectof Intermittent Fasting onReproductive Hormone Levels inFemales and Males: A Review ofHuman Trials.Nutrients2022,14,2343.

Uso de marihuana en el deporte
El potencial del cannabis para afectar el ejercicio y el rendimiento deportivo debe apreciarse en relación con su farmacología general. Además de las principales plantas productoras de cannabis naturales, Cannabis sativa, Cannabis indica y Cannabis ruderalis, existen numerosos híbridos cultivados comercial e ilegalmente.
Las preparaciones de cannabis tienen un uso generalizado en la medicina occidental para un número muy amplio de indicaciones como analgesia, sedación, convulsiones, asma, estimulación del apetito y relajación muscular.
Dependiendo del deporte, las drogas, ilícitas o no, se toman por una variedad de propósitos. Estos incluyen el aumento de la fuerza, la resistencia, el alivio del dolor o el temblor y, en algunos deportes, brindan una sensación de calma y relajación.
Sin embargo, el cannabis es categorizado como una sustancia ergolítica (afecta el rendimiento) más que ergogénica (contribuye al rendimiento deportivo).
Impacto en el rendimiento y la recuperación
Es importante aclarar que se requiere de pruebas sólidas para hacer conclusiones definitivas sobre la asociación entre el consumo de cannabis y el rendimiento atlético.
En términos de un efecto negativo en el rendimiento, Steadward y Singh encontraron que la frecuencia cardíaca y la presión arterial se elevaron después del consumo de marihuana durante el ejercicio, y la capacidad de trabajo disminuyó un 25% en una frecuencia cardíaca de 170 lpm.
Así mismo, algunos estudios demostraron que el consumo de cannabis influyó negativamente el rendimiento en ejercicios de cicloergómetro sin contacto.
También, Shapiro et al. reportó los primeros resultados incompletos de su estudio como un resumen, concluyendo que la tolerancia al ejercicio luego de fumar marihuana disminuyó en siete hombres sanos por 5.5 min.
El pequeño número de estudios científicos muestran que el cannabis disminuye el rendimiento aeróbico o no tiene ningún efecto sobre él y puede afectar la coordinación en algunos deportes.
Aunque no hay evidencia de mejoras en el rendimiento físico, se ha postulado que las alteraciones en la cognición y el afecto afectan el rendimiento debido a los sentimientos de euforia posteriores al uso, sin embargo, esto puede tener efectos de alivio del estrés y la ansiedad en un entorno competitivo.
Así mismo, el cannabis puede jugar un papel muy importante en el manejo del dolor después de una lesión y la fatiga del entrenamiento debido a sus efectos analgésicos. Además, el THC ha tenido efectos ansiolíticos en dosis bajas, lo que puede llevar a los atletas a usarlo para aliviar la ansiedad antes, durante y después del rendimiento, de igual manera el CBD se utiliza por sus efectos ansiolíticos para mejorar la eficiencia del sueño.
Los efectos psicológicos agudos dependen de la vía de administración de la dosis, la experiencia del usuario incluye alteraciones en el estado de ánimo, la percepción y la relajación, pero también se ven afectadas las funciones superiores de la percepción, el aprendizaje del tiempo de reacción y la memoria.
El deterioro de la función persiste durante más de tres horas después de dosis únicas. Los efectos adversos generalmente ocurren después de grandes dosis únicas e incluyen ansiedad aguda, ataques de pánico y alucinaciones.
Los efectos fisiológicos se pueden dividir en pulmonares y cardíacos.
Se concluyó que la marihuana fumada y el THC oral son broncodilatadores y que el uso a largo plazo se asocia con síntomas respiratorios de tos, sibilancias y flema.
Se han asociado varios eventos cardiovasculares adversos graves con fumar cannabis: infarto de miocardio, muerte súbita, miocardiopatía, accidente cerebrovascular, isquemia cerebral transitoria y arteritis periférica.
Hay muchos informes de casos que asocian el THC y los análogos con efectos cardíacos adversos, los cuales incluyen: cambios en la frecuencia cardíaca, función cardíaca, presión arterial, hipotensión ortostática, sensibilidad ventilatoria al dióxido de carbono y flujo sanguíneo de las extremidades. Estos efectos, combinados con la reducción comprobada del umbral anginoso, representan un riesgo en los atletas mayores y en aquellos con enfermedades cardíacas no diagnosticadas.
Prohibiciones
El cannabis se utiliza ampliamente como complemento de la actividad deportiva y sigue prohibido en la competición deportiva. Si su uso es contrario al espíritu del deporte seguirá siendo un tema de continua controversia.
La Agencia Mundial Antidopaje (AMA) coloca una droga en su lista prohibida si mejora el rendimiento, representa un riesgo para el atleta o es contraria al espíritu del deporte. Desde 2004, el cannabis ha estado en la lista prohibida para todos los deportes de competencia.
Conclusión
Los deportistas consumen cannabis por sus propiedades relajantes y analgésicas más que por aumentar la fuerza o la velocidad.
Abreviaciones
Elta-9-tetrahidrocannabinol (THC)
Cannabidiol (CBD)
Lpm (latidos por minuto)
La Agencia Mundial Antidopaje (AMA/WADA)
Referencias
Michael C. Kennedy. Cannabis: Exercise performance and sport. A systematic review. Journal of Science and Medicine in Sport 20 (2017) 825–829.
Steadward R.D., Singh M.: The effects of smoking marijuana on physical performance. Med Sci Sports Exerc 1975; 7: pp. 309-311.
Michael C. Kennedy. Cannabis: Exercise performance and sport. A systematic review. Journal of Science and Medicine in Sport 20 (2017) 825–829.
Jamie F, Christian P, Andreas M, Scott H, Graeme L. Cannabis and Athletic Performance. Sports Medicine (2021) 51 (Suppl 1):S75–S87.
Shapiro B.J., Riss S., Sullivan S.F., et. al.: Cardiopulmonary effects of marijuana smoking during exercise abstract. Chest 1976; 70: pp. 441.

Principales factores de riesgo del suicidio
La ONU define la juventud como la etapa que comienza a los 15 y se prolonga hasta los 25 años de vida de todo ser humano. Es una etapa que la mayoría de los seres humanos viven con intensidad, pero, a pesar de ello, existen situaciones que los llevan a desestabilizarse y querer acabar con su vida, y así es como aparecen las conductas suicidas.
El suicidio es uno de los factores más importantes de morbilidad en jóvenes: ocupa la segunda causa de muerte en el mundo (OMS).
Definiciones
- Factores de riesgo suicida: factores predisponentes que pueden desencadenar un acto suicida.
- Ideación suicida: pensamientos acerca de la voluntad de quitarse la vida, con o sin planificación o método.
- Parasuicidio: acto con un fin no fatal, que provoca autolesiones.
- Intento suicida: cualquier acto de autoperjuicio infligido con intención autodestructiva.
- Suicido: considerado un fenómeno universal, atemporal y con diversas concepciones culturales y sociopolíticas. Se define como “el acto con resultado letal, deliberadamente iniciado y realizado por la víctima”.
Ideación e intento suicida
Todo comienza con la ideación suicida la cual es un marcador de vulnerabilidad y puede desencadenar el intento de suicidio.
La presencia de la ideación y el intento suicida es más frecuente en las mujeres jóvenes que en los hombres. En los adolescentes y jóvenes universitarios a nivel mundial el riesgo de ideación y conductas suicidas es alto y aumenta potencialmente cuando hay presencia de depresión y consumo de alcohol o sustancias psicoactivas.
En un estudio realizado en tres universidades de Massachusetts (EE. UU.) los resultados mostraron que uno de cada diez estudiantes universitarios considera seriamente el suicidio y que la gravedad de la depresión contribuye a la presencia de ideación suicida.
Factores de riesgo
La OMS define los factores de riesgo como cualquier rasgo, característica o exposición de un individuo que aumente su probabilidad de sufrir una enfermedad o lesión. Entre los factores de riesgo más importantes encontrados en las diferentes investigaciones se encuentran:
Emociones negativas y eventos estresantes
Un estado emocional negativo, una perspectiva de futuro negativa, reporte de abuso sexual, sentimiento de soledad, pensamientos de muerte, desesperanza, pesimismo y desmotivación.
El duelo por el suicidio de un familiar o un amigo es un factor de riesgo para el suicidio.
Interacciones familiares, relaciones conyugales, relaciones interpersonales
Los adolescentes y los jóvenes son particularmente propensos a desarrollar tendencias suicidas e ideaciones debido al estilo de pensamiento egocéntrico asociado con ese periodo de la vida.
Los factores causales más relevantes de la conducta suicida en esta población son los problemas con los padres, seguidos de los problemas con la pareja.
Conflictos con los padres por la falta de comprensión y entendimiento de los progenitores de la etapa compleja del desarrollo por la que transitan sus hijos, lo que genera en ellos sentimientos de culpa y de inferioridad (no le conceden importancia a escuchar al adolescente). Las dificultades existentes entre los adolescentes y adultos dependen más de los padres que de los hijos.
Factores biopsicosociales
Subvaloración, extrema ansiedad, depresión, ausencia de solución de sus problemas, consumo de alcohol, antecedentes patológicos familiares, comportamientos suicidas previos, uso de sustancias, comportamientos violentos y abuso sexual.
Problemas laborales, desigualdad social
Deudas, desempleo y pertenecer a familias con condición económica baja.
Conclusión
La escucha y el apoyo social en todos los niveles o redes sociales (familia, amigos, pares, profesores, etc.) son determinantes en la prevención y de la misma manera que se generen políticas de inclusión y oportunidades para ellos.
Referencias
Prevención del suicidio. En: Organización Mundial de la Salud [en línea] [consultado el 17/05/2022].
Cañón S, Carmona J. Ideation and suicidal behaviors in adolescents and Young. Rev Pediatr Aten Primaria. Madrid, 2018, 20(80).

DIFERENCIAS ENTRE LA PROTEÍNA DE ORIGEN ANIMAL Y LA DE ORIGEN VEGETAL
Las proteínas son las macromoléculas orgánicas más abundantes en las células vivas, y en el ser humano. Se desempeñan como componentes estructurales, enzimas, hormonas, mensajeros, transportadores y componentes del sistema inmune, entre otras. Están construidas a partir de un conjunto de 20 aminoácidos, de los cuales nueve no pueden ser sintetizados en el organismo, por lo que se les considera aminoácidos esenciales. El valor biológico o la calidad de la proteína dietética está determinado fundamentalmente por la composición y la disponibilidad de los aminoácidos esenciales.
Junto a lo anterior, la calidad de la proteína puede verse afectada por diversos factores. Las proteínas de origen animal, por ejemplo, se digieren con mayor facilidad que las de origen vegetal, ya que estas últimas por lo general, están almacenadas en gránulos, lo que las hacen menos accesibles a las enzimas digestivas. Algunas plantas contienen inhibidores de las enzimas digestivas, sin embargo, estos se inactivan con el calor, lo que lleva a un aumento de la digestibilidad con el proceso de cocción.
La proteína es esencial para el cuerpo, especialmente si estás buscando desarrollar músculo. Dependiendo de su nivel de actividad, el rango aceptable de distribución es entre el 10 y 35% de la ingesta calórica diaria (American Journal of Clinical Nutrition), esto quiere decir que cuanto más activo seas, más proteínas necesitarás.
PROTEÍNA DE ALIMENTOS DE ORIGEN ANIMAL
Los alimentos de origen animal (carnes de res, cerdo, aves, pescado, mariscos, huevos y lácteos) además de constituir una buena fuente de proteína y aminoácidos esenciales, son fuentes importantes de cobalamina (vit B12), zinc, fósforo, y de hierro hemo, este último es absorbido en 15% – 40% en comparación con el hierro no hemo presente en las plantas (1% – 15%).
De igual manera, el zinc contenido en las carnes es mejor absorbido que el presente en las plantas, debido a la presencia de componentes anti nutricionales como oxalatos, fitatos y taninos que pueden disminuir su absorción.
PROTEÍNA DE ORIGEN VEGETAL
Las proteínas de origen vegetal, suelen percibirse como una fuente de proteína incompleta al contener una menor o nula cantidad de alguno de los aminoácidos esenciales, al que se le denomina aminoácido limitante.
De acuerdo con el International Society of Sports Nutrition Journal los aminoácidos que faltan con mayor frecuencia en las proteínas de origen vegetal son la metionina, la isoleucina, la lisina, la treonina y el triptófano. La isoleucina es uno de los tres aminoácidos BCAA, indispensables en los procesos de desarrollo muscular y resistencia.
TIPOS
Las fuentes de proteínas más comunes en los polvos de origen vegetal son las proteínas de arroz integral, soya, cáñamo, chícharo, remolacha (betabel) y garbanzos.
Las proteínas de soya y chícharo sobresalen debido a que se consideran proteínas completas al contar con los nueve aminoácidos esenciales y en consecuencia son excelentes suplementos para el desarrollo y mantenimiento muscular. Un estudio realizado por The Journal of the International Society of Sports Nutrition descubrió que la proteína de chícharo produjo la misma ganancia de desarrollo muscular que el suero de leche.
Por otro lado, la proteína de arvejas y el trigo de acuerdo con la FAO se consideran proteínas de baja calidad.
El análisis de la composición de cereales como el trigo, el mijo y el maíz, coinciden en que, la cisteína, metionina, treonina y triptófano son los que se presentan en mayores cantidades, mientras que la lisina es el aminoácido limitante. En las leguminosas se identificaron como principales aminoácidos limitantes la metionina y cisteína. También se reportan deficiencias de metionina en las nueces de macadamia, mientras que las nueces de Brasil, presentan un alto contenido de metionina.
CONSUMO DE PROTEÍNAS Y DESARROLLO DE ENFERMEDADES CRÓNICAS NO TRANSMISIBLES
Si bien las proteínas de origen animal se caracterizan por su mayor digestibilidad y calidad, su consumo se ha relacionado con un aumento en el riesgo de sufrir enfermedades cardiovasculares, las cuales de acuerdo con la OMS constituyen la mayoría de las muertes por enfermedades no transmisibles, representando más de 17,9 millones de personas al año.
En personas con al menos un factor de riesgo (sedentarismo, tabaquismo, exceso de peso o consumo de alcohol), el consumo de proteínas de origen animal incrementó el riesgo de mortalidad por enfermedad cardiovascular en 10,8%, mientras que el mayor consumo de proteínas de origen vegetal redujo la mortalidad por todas las causas en 9%. Además, el consumo de proteínas de origen vegetal se asocia a una menor presión arterial y menores niveles de colesterol LDL.
El consumo de carnes rojas o procesadas se asoció a un mayor riesgo de HTA, DMT2, hipercolesterolemia. Mientras que el consumo de proteínas vegetales significó un menor riesgo cardiovascular, el cual podría estar asociado tanto al tipo como a la cantidad de grasa.
Los resultados de un estudio estimaron que el consumo de una porción diaria de nueces disminuye en un 30% el riesgo de enfermedad cardiovascular, al compararla con una porción diaria de carne roja. De manera similar, una porción de lácteos, pollo y pescado, disminuyó el riesgo de presentar esta condición.
IMPACTO AMBIENTAL
Actualmente, en las dietas occidentales, la proporción de proteína consumida de origen animal versus proteína de origen vegetal está causando serios daños al ambiente, dado el alto impacto que la producción de ganado vacuno, porcino, aviar y la acuacultura, producen en la emisión de gases tipo invernadero en comparación con la producción de alimentos fuente de proteínas de origen vegetal.
REFERENCIAS
Quesada D, Gómez G. (2019). Proteins of vegetable or animal origin? A look at their impact on health and environment. Rev. Nutr. Clin. Metab. 2019;2(1):XX.

¿Hasta qué punto la actividad física deja de ser saludable?
La OMS define la actividad física como “cualquier movimiento corporal producido por los músculos esqueléticos, con el consiguiente consumo de energía”.
Muchas entidades médicas, incluidos los Centros para el Control y la Prevención de Enfermedades (CDC) y el Colegio Estadounidense de Medicina Deportiva (ACSM), recomiendan la actividad física ya que es una importante herramienta de salud pública utilizada en el tratamiento y prevención de diversas enfermedades como las cardiopatías, la hipertensión arterial y la diabetes mellitus tipo 2, así como también para algunas enfermedades psiquiátricas como los trastornos depresivos y de ansiedad, además de algunas enfermedades físicas.
De acuerdo a los CDC y el ACSM, los adultos deben acumular 30 minutos o más de actividad física de intensidad moderada la mayoría de los días de la semana, preferiblemente todos.
Por otro lado, los estudios han demostrado que además de sus efectos beneficiosos, la actividad física también puede estar asociada con problemas de salud mental, relacionándose con trastornos como el “ejercicio excesivo” y el “síndrome de sobreentrenamiento”.
ACTIVIDAD FÍSICA Y MEJORA DE LA SALUD MENTAL
La relación entre la mejora del estado de ánimo y la actividad física, no parece ser universal, puesto que, a mediano o largo plazo no se han demostrado mejoras consistentemente para individuos normales.
Por otro lado, hay estudios que informan la mejora de otros aspectos, como la autoestima, la vitalidad, el bienestar general y la satisfacción con la apariencia física.
MECANISMOS
Se han propuesto varias hipótesis psicológicas para explicar los efectos beneficiosos de la actividad física sobre la salud mental, siendo los principales:
- Distracción: la desviación de los estímulos desfavorables conduce a un mejor estado de ánimo durante y después del ejercicio.
- Autoeficacia: dado que el ejercicio físico puede verse como una actividad desafiante, podría mejorar el estado de ánimo y la confianza en uno mismo.
- Interacción social: el apoyo mutuo que ocurre entre los individuos involucrados en el ejercicio, juega un papel importante en los efectos del ejercicio sobre la salud mental.
ACTIVIDAD FÍSICA Y PROBLEMAS DE SALUD MENTAL
Ejercicio excesivo
Para algunos individuos, la actividad física se convierte en una obsesión, resultando en una preocupación exagerada por el ejercicio y un entrenamiento excesivo aún en presencia de contraindicaciones médicas.
Los estudios sobre el tema han caracterizado esta condición desde un principio como un análogo de la anorexia nerviosa o como una adicción, donde los individuos no muestran signos de enfermedad, sino que presentan una buena salud mental. Sin embargo, no dejan dudas con respecto a las posibilidades de daño físico significativo causado por el ejercicio excesivo.
Dismorfia muscular
La actividad física puede estar asociada con una condición de alteraciones en la imagen corporal que se encuentra entre algunos levantadores de pesas y fisicoculturistas, donde los individuos, aunque grandes y musculosos, creen que son débiles y flacos. En principio, se han sugerido denominaciones como “vigorexia” y “anorexia inversa” para esta condición.
Pope H, et al., propusieron los siguientes criterios para el diagnóstico de “dismorfia muscular”:
Preocupación excesiva con la idea de que su cuerpo no es lo suficientemente delgado (en términos de bajo contenido de grasa) y musculoso.
- Esta preocupación causa incomodidad y deterioro significativo del funcionamiento social.
- Esta preocupación no puede explicarse por ningún otro trastorno psiquiátrico. Además de su asociación con la actividad física, la evidencia indica una relación entre la presencia de dismorfia muscular y antecedentes de trastornos del estado de ánimo, ansiedad y alimentación, así como el uso de esteroides anabólico-androgénicos.
Uso de esteroides anabólico-androgénicos
Son utilizados casi exclusivamente por personas físicamente activas, lo que representa una situación más en la que se puede observar una asociación entre la actividad física y el deterioro de la salud mental.
El efecto de estas sustancias se caracteriza por aumentos significativos de la irritabilidad y la agresividad y por la aparición de síntomas maníacos y psicóticos –que pueden incitar a algunos usuarios a cometer actos delictivos–, así como de síntomas depresivos durante los períodos de abstinencia. Además, se ha sugerido que el uso continuado de estas sustancias puede conducir a una condición de dependencia.
Actividad física intensa y alteraciones del estado de ánimo
A medio y largo plazo, la mejora del estado de ánimo parece ser asociada con actividad física de intensidad moderada, mientras que se ha informado empeoramiento del estado de ánimo después de ejercicios de alta intensidad que duran de 10 días a algunas semanas.
Síndrome del sobreentreno
Para alcanzar la meta de mejorar el rendimiento (normalmente al final de la temporada), el atleta tiene que alcanzar sus límites de capacidad física (o incluso un poco más allá) por medio de un entrenamiento excesivo (o descanso insuficiente), generando un deterioro del estado de ánimo.
Se debe considerar el diagnóstico de síndrome de sobreentrenamiento cuando el deportista presenta un deterioro del rendimiento deportivo tras o durante un periodo de entrenamiento intenso que no mejora con descansos breves (1 ó 2 semanas), acompañado de fatiga persistente, capacidad reducida para realizar entrenamiento intenso, sensación de musculatura sensible o dolorosa, alteraciones del sueño, disminución del apetito, y cambios de humor como apatía, irritabilidad y depresión, es decir, un cuadro similar al trastorno depresivo.
Peluso M, et al. Physical activity and mental health: the association between exercise and mood. CLINICS, 60(1):61-70, 2005.
Pope HG Jr, Gruber AJ, Choi P, Olivardia R, Phillips K. Muscledysmorphia: an underrecognized form of body dysmorphicdisorder. Psychosomatics, 1997;38:548-557.
OMS (2020). Actividad física.

USO EXCESIVO DE LAXANTES
Un laxante es una preparación usada para provocar la defecación o la eliminación de heces. Existen muchos tipos de laxantes con mecanismos de funcionamiento y potencia diferente. Aunque hay muchos grupos de laxantes, para simplificarlos podríamos clasificarlos en cuatro grupos:
- Formadores de masa: aumentan el volumen de las heces y disminuyen su consistencia.
- Osmóticos: disminuyen la consistencia de las heces al arrastrar agua consigo.
- Emolientes: provocan una contracción de los músculos de los intestinos, sobre todo el grueso, y hacen que avance más deprisa la materia fecal.
- Procinéticos: aunque no son propiamente laxantes, pueden actuar como tales, ya que actúan sobre los músculos del intestino aumentando su fuerza de contracción.
Algunas de las consecuencias más comunes de usar laxantes en exceso son las siguientes:
- Estreñimiento
- Diarrea
- Impactación fecal
ESTREÑIMIENTO
El estreñimiento es el movimiento lento de la materia fecal a través del intestino grueso. Mientras más tiempo se demora la materia fecal en recorrer el intestino grueso, más líquido pierde y se vuelve más seca y dura. Es posible que el paciente tenga dificultad con la evacuación intestinal, que deba pujar más para evacuar el intestino o que tenga menos deposiciones que las habituales. Algunas causas del estreñimiento son las siguientes:
Uso de medicamentos
- Opioides.
- Medicamentos para la ansiedady la depresión.
- Antiácidos.
- Diuréticos(medicamentos que aumentan la cantidad de orina que produce el cuerpo).
- Medicamentos para dormir.
Alimentación
- Consumo insuficiente de agua u otros líquidos.
- Alimentación escasa, en especial con bajo contenido de fibra
Hábitos de evacuación intestinal
- La costumbre de evitar ir al baño cuando se siente la necesidad de evacuar el intestino.
- Uso excesivo de laxantes.
Afecciones que limitan la actividad y el ejercicio
- Inactividad al pasar mucho tiempo en la cama o no hacer ejercicio.
Ambiente
- Recorrido muy largo para ir al baño.
- Necesidad de pedir ayuda para ir al baño.
- Estadía en lugares poco conocidos.
- Poca o ninguna privacidad.
- Sensación de que debe apurarse.
- Calor excesivo que causa deshidratación.
- Uso de bacinilla (orinal) o un inodoro portátil.
Tratamiento:
- Mantenga un registro diario de las evacuaciones intestinales.
- Beba suficiente líquido todos los días.
- Haga ejercicio con regularidad.
- Aumente la cantidad de fibra insoluble en su alimentación:
- Frutas: pasas de uva, ciruelas, fresas, duraznos y manzanas.
- Verduras: calabacín, brócoli, zanahorias y apio.
- Cereales integrales, panes de granos integrales y salvado.
- Frutos secos.
DIARREA
Diarrea significa tener deposiciones que son blandas, sueltas o líquidas, con más frecuencia que lo normal. Si la diarrea es grave o si dura mucho tiempo, el cuerpo no absorbe el agua ni los nutrientes. Esto puede hacer que padezca deshidratación o desnutrición.
IMPACTACIÓN FECAL
La impactación fecal es la acumulación de materia fecal seca que no sale del cuerpo, causada habitualmente por el uso excesivo de laxantes.
Síntomas de impactación fecal
- Incapacidad de producir una evacuación intestinal.
- Necesidad de pujar más fuerte para producir cantidades pequeñas de materia fecal dura y seca.
- Menos evacuaciones intestinales de lo habitual.
- Diarrea repentina y explosiva (a medida que la materia fecal pasa alrededor de las heces retenidas).
- Náuseas y vómitos.
- Pérdida de materia fecal al toser.
- Deshidratación.
- Problemas para respirar, latidos rápidos del corazón, mareos o presión arterial baja e hinchazón del abdomen.
- Confusión y pérdida del sentido del tiempo y el lugar, con latidos rápidos del corazón, sudoración, fiebre y presión arterial alta o baja.
- Dolor en la espalda o el abdomen.
- Cambio en la frecuencia para orinar, o no poder orinar.
*Estos síntomas se deben informar al proveedor de atención de la salud.
Es necesario acudir a un profesional de la salud antes de consumir cualquier tipo de laxante para evitar sus efectos adversos.
Complicaciones gastrointestinales (PDQ®)–Versión para pacientes publicada originalmente por el Instituto Nacional del Cáncer. (2020).
Rey. Servicio de Aparato Digestivo. Hospital Clínico San Carlos. Madrid. Rev. esp. enferm. dig. 98:4.
